Аміак – ПІДГРУПА НІТРОГЕНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 10. ПІДГРУПА НІТРОГЕНУ
§ 10.3. Аміак
Будова молекули. Нітроген утворює з гідрогеном кілька сполук, з яких найважливішою є аміак. Електронна формула молекули аміаку така:
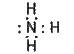
Видно, що з чотирьох електронних пар у нітрогену – три спільні (зв’язуючі) і одна неподілена (незв’язуюча).
Будову молекули NH3 розглянуто раніше (див. рис. 3.4). Вона має форму піраміди. Хімічний зв’язок N-Н полярний: позитивний
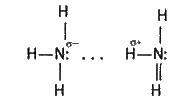
Внаслідок водневих зв”язків аміак має порівняно високі температури плавлення і кипіння, а також значну теплоту випаровування, він легко зріджується.
Фізичні властивості. Аміак – безбарвний газ з характерним різким запахом, майже у два рази легший за повітря. При збільшенні тиску або охолодженні він легко зріджується у безбарвну рідину (температура кипіння -33,4°С). Аміак дуже добре розчиняється у воді (при
Розчин аміаку у воді називається аміачною водою, або нашатирним спиртом. Під час кип’ятіння розчинений аміак звітрюється з розчину.
Хімічні властивості. Велика розчинність аміаку у воді зумовлена утворенням водневих зв’язків між їх молекулами:
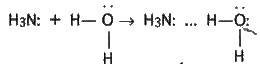
Однак, крім таких гідратів аміаку,1 частково утворюються іони амонію і гідроксид-іони:
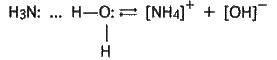
Гідроксид-іони зумовлюють слабколужну (їх мало) реакцію аміачної води. При взаємодії їх з іонами NH+4 знову утворюються молекули NH3 і Н2О, сполучені водневим зв’язком, тобто реакція відбувається у зворотному напрямку. Утворення іонів амонію та гідроксид-іонів в аміачній воді можна зобразити рівнянням:
NH3 + Н2О ⇆ NH3 ∙ Н2О ∙ NH+ + ОН-.
В аміачній воді найбільша частина аміаку міститься у вигляді молекул NH3, рівновага зміщена в бік утворення аміаку, тому вона пахне аміаком. Незважаючи на це, водний розчин аміаку за встановленою традицією позначають формулою NH4OH 1 і називають гідроксидом амонію, а лужну реакцію розчину пояснюють дисоціацією молекул NH4OH:
NH4OH ⇆NH+ + ОН-
Оскільки в розчині аміаку у воді концентрація гідроксид – іонів невелика, гідроксид амонію належить до слабких основ.
Отже, в реакції взаємодії аміаку з водою до молекули аміаку приєднується протон з води, внаслідок чого утворюється катіон амонію NH+4 і гідроксид-іон ОН. У катіоні амонію чотири ковалентних зв’язки, один з них утворений за донорно-акцепторним механізмом (див. § 3.1).
Важливою хімічною властивістю аміаку є його взаємодія з кислотами з утворенням солей амонію. У цьому разі до молекули аміаку приєднується іон гідрогену кислоти, утворюючи іон амонію, що входить до складу солі:
NH3 = НСl + NH4Cl; .
NH3 + Н3РО4 = NH4H2PO4.
З наведених прикладів випливає, що для аміаку характерна реакція приєднання протона.
Аміак згоряє у кисні і в повітрі (попередньо підігрітому) з утворенням азоту і води:
4NH3 + 3О2 = 2N2 + 6Н2О.
За наявності каталізатора (наприклад, платини, оксиду хрому(ІІІ)) реакція відбувається з утворенням оксиду нітрогену(ІІ) і води:
4NH3 + 5O2 = 4NO + 6Н2О.
Ця реакція називається каталітичним окисненням аміаку.
1 Оскільки такої речовини немає, то всупереч традиції її можна зображати як гідрат NН3 ∙ Н2О або просто NН3 (без гідроксид-іона).
Аміак – сильний відновник. При нагріванні він відновлює оксид купруму(ІІ), сам окиснюється до вільного азоту:
+2 -3 0 0
ЗСuО + 2NH3 = ЗСu + N2 + ЗН2О;
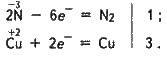
За допомогою цієї реакції можна добути азот в лабораторних умовах.
Добування і застосування. В лабораторних умовах аміак звичайно добувають слабким нагріванням суміші хлориду амонію з гашеним вапном:
2NH4Cl+ Са (ОН)2 = СаСі2 + 2NH3 ↑ + 2Н2О.
Ця реакція грунтується на зміщенні рівноваги взаємодії аміаку з водою при додаванні гідроксид-іонів:
NH+ + ОН – ⇆ NH3 ↑ + Н2O.
Основним способом добування аміаку у промисловості є його синтез з азоту і водню. Реакція екзотермічна і оборотна:
N2 + ЗН2 ⇆ 2NH3, ∆ Н° = -92,4 кДж.
Вона відбувається тільки за наявності каталізатора – губчастого заліза з домішками активаторів – оксидів алюмінію, калію, кальцію, силіцію (іноді й магнію). Вихідні продукти добувають: азот – з рідкого повітря, водень – конверсійним способом або з води (див. § 8.2).
Великі кількості аміаку витрачаються для добування нітратної (азотної) кислоти, азотовмісних солей, сечовини, соди за аміачним методом. На легкому зрідженні і подальшому випаровуванні з поглинанням теплоти грунтується “його застосування в холодильній справі.
Рідкий аміак та його водні розчини застосовують як рідкі добрива.
1 Гідрати – продукти приєднання води до речовин.
