Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
4.2. Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин
Атомно-молекулярне вчення – це сукупність аксіом і законів, що розглядають речовину, яка складається з атомів. Ось основні його положення:
– усі речовини складаються з атомів. Молекули простих речовин складаються з однакових атомів, а молекули складних – з різних;
– атоми одної хімічної речовини (хімічного елемента)
– унаслідок взаємодії атомів утворюються молекули простих та складних речовин;
– при фізичних явищах молекули не змінюються, а при хімічних – руйнуються;
– під час хімічних реакцій нові речовини утворюються з тих самих елементів, з яких складались вихідні речовини.
Учення розробив М. В. Ломоносов на основі закону збереження маси речовин (1748 р.)1. Сучасне формулювання закону таке: загальна маса речовин, що вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються внаслідок реакції2.
Так,
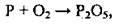
Можна записати:
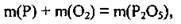
Де m(Р) – маса фосфору,
M(O2) – маса кисню, які вступили в реакцію,
M(Р2o5) – маса фосфор(V) оксиду, що утворився внаслідок реакції.
Збереження мас у хімічних реакціях пояснюють тим, що кількість атомів кожного елемента до і після реакції не змінюється, адже атоми не зникають і не виникають з нічого. Отже, наведена схема не відтворює закону збереження маси речовин, тому що кількість атомів Фосфору й Оксигену в лівій і правій частинах схеми не є однаковою. Щоб перетворити наведену схему реакції в рівняння, потрібно перед формулами речовин поставити певні числа для того, щоб зрівняти кількість атомів елементів у лівій і правій частинах рівняння. Розставивши коефіцієнти, отримуємо:
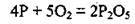
Цей вираз уже є рівнянням хімічної реакції, або хімічним рівнянням.
Коефіцієнти в хімічній реакції показують не лише кількість молекул, що беруть участь у хімічному процесі, а й дають інформацію про кількість речовини реагентів і продуктів реакції. Так, наведене рівняння показує, що при спалюванні 4 моль фосфору потрібно використати 5 моль кисню, а в результаті реакції утворюється 2 моль фосфор(V) оксиду.
Закон сталості складу речовин відкрив французький учений Ж. Л. Пруст (1754-1826)1 Закон у 1808 р. було сформульовано так: кожна хімічно чиста речовина, незалежно від способу добування, завжди складається з тих самих хімічних елементів (має сталий склад), причому співвідношення їхніх мас постійні, а відносні числа їхніх атомів виражаються цілими числами3.
_______________________________________________________________
1 Цей закон набув значного поширення завдяки працям французького вченого Антуана Лавуазьє (1743-1794), який і сформулював його 1789 р.
2 У XX ст. з’ясувалось, що різниця між реагентами і продуктами реакції (дефект мас Am) існує і залежить від внутрішньої енергії. Величина цієї різниці настільки мала (на 6-9 порядків), що за умов вивчення хімії в межах шкільної програми ми можемо нею знехтувати.
3 Однак значно пізніше хіміки довели, що поряд з речовинами сталого складу є сполуки змінного складу. Це, зазвичай, сполуки з немолекулярною будовою (з атомними, йонними і металічними гратками). їхній склад не є сталим і залежить від умов добудування. Речовини сталого складу називають дальтонідами, а речовини змінного складу – бертолідами. Бертоліди трапляються серед сульфідів, гідридів, оксидів, карбідів, нітридів, силіцидів.
