Будова електронних оболонок атомів
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 4. Будова електронних оболонок атомів
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати значення понять “електронна оболонка атома”, “квантове число”, “електронна конфігурація атома”; характеризувати закономірності розподілу електронів у атомах; складати схеми будови атомів, електронні формули атомів хімічних елементів і електронно-графічні формули.
Пригадаємо, що атом складається з ядра та електронної оболонки,
Орбіталі розміщуються на певних відстанях від ядра, мають певну форму та орієнтацію у просторі. Для їх характеристики використовують набір квантових чисел, яких є чотири. Кожне з них дедалі більше уточнює стан електрона в атомі, його місцезнаходження в електронній оболонці.
Головне квантове число n визначає номер енергетичного
Енергетичний рівень – це сукупність орбіталей, які характеризуються однаковим значенням головного квантового числа n
Головне квантове число набуває цілочислових значень, починаючи одиниці (n = 1, 2, 3, … да). Чим більше n тим більшою буде енергія.
З числом n поєднані й інші характеристики енергетичного рівня. Наприклад, число підрівнів на енергетичному рівні дорівнює n – номеру рівня, а число орбіталей на енергетичному рівні n – квадрату номера рівня n2. Отже, максимальне число електронів, які можуть розміститися на n-му рівні (по два на кожній орбіталі), дорівнює 2n2.
Побічне (орбітальне) квантове число l визначає форму атомної орбіталі (АО), на якій розміщений електрон. Воно може набувати цілочислових значень від 0 до n-l (підрівні позначаються буквами).
N | L | AO | |
1 | 0 | 1s | |
2 | 0, 1 | 2s, | 2p |
3 | 0, 1, 2 | 3s, | 3 p, 3 d |
4 | 0, 1, 2, 3 | 4s, | 4p,4d,4f |
Кожному енергетичному рівню з певним значенням п відповідає набір енергетичних підрівнів, число яких дорівнює значенню п.
Магнітне квантове число m характеризує орієнтацію орбіталей у просторі (у зовнішньому магнітному або електричному полях). Воно
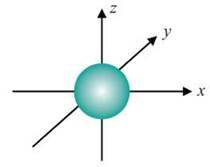
Мал. 5. s-Орбіталь
Може набувати цілочислових значень від -1 до +1 (зокрема, і нуль). При певному значенні l число можливих значень m дорівнює 21 + 1. Так, при l = 0, m = 0. Це означає, що s-орбіталь має одну орієнтацію щодо трьох осей координат (мал. 5). При l = 1m може набувати трьох значень: -1, 0, +1, тобто р-орбіталі мають три орієнтації у просторі – за координатними осями x, y, z (мал. 6).
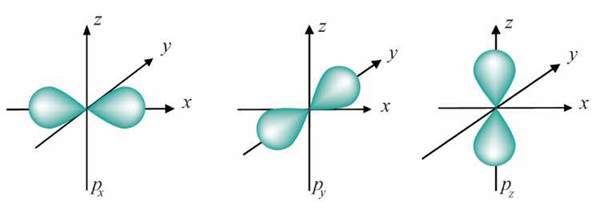
Мал. 6. р-Орбіталі
Умовно атомну орбіталь позначають у вигляді клітинки

S-Підрівню відповідає одна АО

Р-підрівню – три АО

D-підрівню – п’ять АО

А f-підрівню – сім АО

Загальне число орбіталей енергетичного рівня дорівнює n2.
Спінове квантове число ms характеризує власний стан електрона в атомі, який дуже спрощено можна уявити як обертання електрона навколо власної осі. Воно може набувати лише двох значень +1/2 або -1/2, які відповідають двом протилежним одне одному напрямам обертання: Ц.
Отже, електрони в атомі розміщуються на різній відстані від ядра, оскільки вони мають різний запас енергії. Так утворюються електронні шари, які складаються з електронів із близьким значенням енергії.
Їх ще називають енергетичними рівнями.
Число енергетичних рівнів дорівнює головному квантовому числу n, тобто номеру періоду (мал. 7):
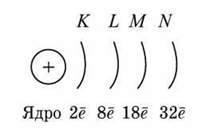
Мал. 7. Схема будови електронної оболонки атома
Головне квантове число n | 1 | 2 | 3 | 4 |
Електронна оболонка | K | L | M | N |
Максимальне число електронів, 2n2 | 2 | 8 | 18 | 32 |
Як саме розподіляються електрони в електронній оболонці? Розподіл електронів у атомі по орбіталях на енергетичних рівнях і підрівнях називається електронною конфігурацією атома. Наприклад, електронна конфігурація атома Натрію 1s22s22p63s1 Зазвичай вона наводиться для основного стану атома (стан з мінімальною енергією).
Для складання електронної конфігурації атома слід пам’ятати певні принципи і правила.
Принцип мінімуму енергії полягає в тому, що першими заповнюються орбіталі з мінімальними рівнями енергії. У межах одного електронного шару найменше значення енергії має електрон, що перебуває на s-орбіталі, а далі – на р-, d-, /-орбіталях (мал. 8).
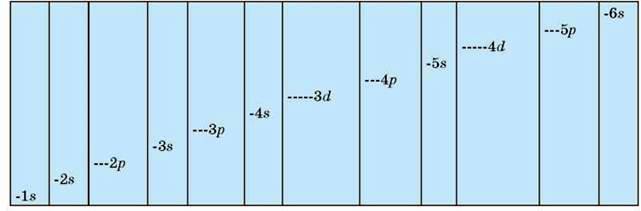
Мал. 8. Енергетична діаграма електронних рівнів і підрівнів
Правила Клечковського. 1. Електрони заповнюють орбіталі в порядку збільшення суми головного та орбітального квантових чисел. 2. Якщо сума n + l однакова, то передусім заповнюється орбіталь з меншим значенням n. Отже, послідовність заповнення орбіталей електронами можна подати таким рядом:
1s2, 2s2, 2р6, 3s2, 3р6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4/14 Запам’ятовувати цей ряд не потрібно. Його використовують під час складання електронних конфігурацій атомів або йонів елементів (див. мал. 8).
Принцип заборони Паулі. В атомі не може бути двох електронів з
Однаковим набором усіх чотирьох квантових чисел:  – заборонено. Це означає, що на одній орбіталі не може бути більше двох електронів з антипаралельними спінами:
– заборонено. Це означає, що на одній орбіталі не може бути більше двох електронів з антипаралельними спінами: – дозволено.
– дозволено.
Правило Хунда. Орбіталі одного підрівня заповнюються електронами в такий спосіб, щоб їх сумарний спін був максимальним:
 – заборонено. Це означає, що спочатку електрони заповнюють орбіталі по одному на кожній, а якщо число електронів більше за число орбіталей, то – по два, утворюючи електронні пари
– заборонено. Це означає, що спочатку електрони заповнюють орбіталі по одному на кожній, а якщо число електронів більше за число орбіталей, то – по два, утворюючи електронні пари
 – дозволено.
– дозволено.
Коротко про головне
Оскільки електрони мають різний запас енергії, вони розміщуються в атомі на різній відстані від ядра, утворюючи електронні шари. Кожному електронному шару відповідає певний рівень енергії електронів, що розміщуються на ньому, тому електронні шари називають ще енергетичними рівнями.
Число енергетичних рівнів у атомі елемента відповідає головному квантовому числу n, тобто номеру періоду в періодичній системі. Енергетичні рівні атомів позначаються також латинськими літерами К, L, M, N, O, P, Q.
Кожний енергетичний рівень поділяється на підрівні, число яких дорівнює номеру рівня.
На одній орбіталі може бути лише два електрони з протилежними спінами.
Електрони розміщуються спочатку по одному на кожній з орбіталей, а потім – по два.
Розподіл електронів у атомі по орбіталях на енергетичних рівнях і підрівнях називається електронною конфігурацією атома. Графічно вона передається за допомоги електронних формул або квантових комірок. Для складання електронної конфігурації атома слід пам’ятати певні принципи і правила.
