Будова і властивості твердих тіл. Кристалічні й аморфні тіла
ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ*
Урок № 16
Тема. Будова і властивості твердих тіл. Кристалічні й аморфні тіла
Мета: вдосконалити знання учнів про капілярні явища та сили поверхневого натягу; розкрити основні властивості кристалічних і аморфних тіл, сформувати вміння розпізнавати кристалічні та аморфні тіла, знати приклади кристалічних решіток.
Тип уроку: комбінований.
Обладнання: листки з інформацією, прислів’я, графіт, скло, сажа, таблиці з кристалічними решітками, сіль.
Основні поняття: кристалічні тіла, монокристали,
Хто наважиться стверджувати, що ми знаємо все, що може бути пізнано?
Г. Галілей
ХІД УРОКУ
I. Розминка
Пояснити прислів’я з точки зору фізичних явищ.
– Смола до дуба не пристане.
– Де оре сошка, там хліба трошки.
– Хто як скородить, так йому і родить.
– На дощі змокнеш і в плащі.
– Він, як вода, скрізь просочиться.
– Не лізь в болото, не будеш мити ноги.
– Не в кожній воді мило розпуститься.
– Розтеклось добро, як олія по воді.
II. Актуалізація опорних знань
Спробуйте пригадати все, що ви пов’язуєте
Інтерактивна вправа “Мозковий штурм”, учні працюють у групах, збирають інформацію, а потім захищають свої ідеї від групи.
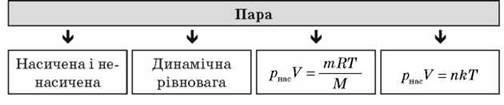

III. Вивчення нового матеріалу
З попередніх класів ми знаємо про основні властивості твердих тіл: збереження форми і об’єму, характер молекулярного руху – коливання атомів чи молекул біля положення рівноваги. Тверді тіла поділяються на дві великі групи – кристалічні та аморфні, які відрізняються своїми властивостями.
Кристалічні тіла мають певну температуру плавлення і кристалізації, розміщення в них молекул (атомів, іонів) упорядковане (розташування їх в певному напрямку повторюється). Кристалічну природу мають більшість металів, мінералів, рослинні волокна, білкові речовини, сажа, лід, графіт.

Властивості кристалів
1. Анізотропія фізичних властивостей (їх залежність від вибраного в кристалі напряму).
2. Наявність температури плавлення. Кристалічне тіло, досягаючи температури плавлення, починає плавитися. Уся енергія, що підводиться до тіла, витрачається на збільшення потенціальної енергії взаємодії молекул під час руйнування кристалічних решіток, а кінетична енергія молекул стабільна, тому температура тіла під час плавлення не змінюється.
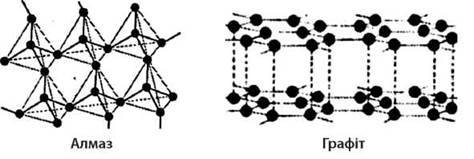
3. Властивості кристала зумовлюються не лише тим, із яких атомів він складається, але й видом кристалічних решіток. Наприклад, із одних і тих же атомів Карбону складаються алмаз і графіт, але фізичні властивості в них різні:
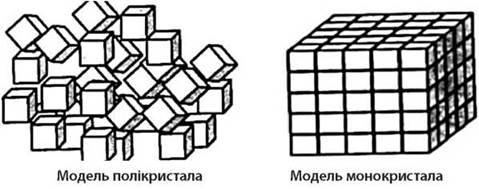
Більшість твердих тіл, які зустрічаються в природі чи виробляються штучно (мінерали, метали, кераміка), має полікристалічну будову.
Полікристали – тверді тіла, які складаються з безлічі безладно орієнтованих дрібних кристалічних зерен – кристалітів (дрібних моно-кристаликів).
Монокристали – великі поодинокі кристали, у яких в межах всього їх об’єму зберігається дальній порядок розташування частинок.
Великі кристали в природі бувають дуже рідко. Потреба промисловості, науки і техніки в кристалах велика, їх застосовують у радіотехніці, оптиці та інших галузях. Наприклад, кристали рубіну використовують у квантових генераторах – лазерах. За допомогою кристалів сегнетової солі добувають ультразвукові коливання. Штучно виготовляють монокристали кварцу, алмазу, корунду, рубіну. Для їх росту потрібні особливі умови.
Кристалічна решітка – умовне зображення далекого порядку в монокристалах. Частинки, з яких складається кристал, під час теплового руху коливається навколо положення рівноваги, які називають вузлами. Якщо з’єднати сусідні вузли, матимемо зображення кристалу – решітку.
Кристал називають ідеальним, якщо його можна утворити простим паралельним повторенням у просторі елементарної комірки подібно до того, як великий цегляний будинок будується з цеглинок. Реальні кристали завжди мають дефекти: домішкові атоми на місцях основних, порожні вузли, різні порушення впорядкованості. Дефекти значно знижують міцність твердого тіла, але бувають і корисними (як у напівпровідників з домішками).
Анізотропія кристалів – це неоднаковість більшості фізичних властивостей речовини в різних напрямах (механічних, теплових, електричних, магнітних, оптичних). Причиною є впорядковане розміщення атомів.
Типи кристалів
Залежно від характеру сил взаємодії і природи частинок у вузлах кристали поділяються на:
1) атомні (Ge, С, Si) – мають міцний ковалентний зв’язок, високу твердість, малу електропровідність. У вузлах решітки знаходяться нейтральні атоми, які утримуються ковалентними зв’язками квантово-механічного походження. Таку будову має кристалічна решітка алмазу;
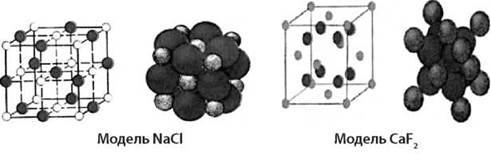
2) іонні (солі NaCl, AgBr, KJ, СаСO3) – зв’язок між іонами у вузлах зумовлений кулонівськими силами притягання.
3) металеві (метали) – зв’язок забезпечують сили притягання між позитивними іонами і негативним електронним газом. Добрі провідники теплоти й електрики, пластичні, непрозорі;
4) молекулярні (нафталін, парафін, лід Н2O, сухий лід СO2, Вr2, СН4) – зв’язок зумовлений силами міжмолекулярної взаємодії Ван-дер-Ваальса;
5) аморфні тіла (переохолоджені рідини) – пластичні, не мають певної температури плавлення (просто зменшується в’язкість), молекули їх не утворюють кристалічної решітки.
Аморфні тіла у твердому стані мають внутрішню будову, подібну до рідини (тобто існує близький порядок розміщення сусідніх частинок). Залежно від характеру впливу поводяться або як тверді тіла, або як в’язкі рідини. Аморфними також є речовини, які можуть існувати у двох формах: кристалічній та аморфній. Це поліетилен, цукор, скло, каніфоль. Аморфний стан нестійкий. Через деякий час аморфна речовина переходить у кристалічну (скло – мутніє, льодяник – зацукрується).
Аморфні тіла наділені текучістю, тобто із зростанням температури вони поступово розм’якшуються, перетворюючись на в’язку рідину. У цьому виявляється істотна відмінність їх від кристалічних тіл: аморфні тіла не мають певної температури плавлення.
Оскільки в розташуванні атомів або молекул аморфного тіла немає далекого порядку, фізичні властивості аморфного тіла не залежать від напряму, тобто аморфні тіла є ізотропними.
IV. Закріплення вивченого матеріалу
Розв’язування задач
1. Два кубики – один зі скла, інший із монокристалу кварцу – опущені в гарячу воду. Чи збережуть вони свою форму?
2. Як, з огляду на кристалічні решітки твердих тіл (наприклад, на моделі просторових решіток натрій хлориду), пояснити властивість анізотропії?
3. Олово легко розплавити. Чому ж не можна видувати з нього вироби, як це роблять зі скла?
4. Як показати, що скло – тіло аморфне, а кухонна сіль – кристалічне?
V. Підсумок уроку (“Логічний калейдоскоп”)
1. Яка зовнішня ознака кристала є істотною?
2. Чи всі кристалічні тіла анізотропні?
3. Деревина анізотропна. Чи є вона кристалічним тілом?
4. Наведіть приклади аморфних тіл.
VI. Домашнє завдання
Задачі
1. Чому шибки в старовинних соборах, що простояли більше 100 років, виявляються товстішими внизу, ніж угорі?
2. Колби деяких ламп роблять із прозорого сапфіра (Аl2O3). Чому їх не видувають, як скляні вироби, а вирощують із розплаву?
