D-ЕЛЕМЕНТИ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
D-ЕЛЕМЕНТИ
Більшість хімічних елементів-металів знаходиться у В групах періодичної системи елементів.
Звернемося до її будови. Зі збільшенням заряду ядра атома елемента (атомного номера) відбувається послідовне заповнення електронами атомних орбіталей різних енергетичних рівнів, починаючи з найнижчого.
На 1-ому рівні є одна 1s-АО; вона заповнюється в атомів Н і Не – елементів, які утворюють 1-й період.
На 2-ому рівні є одна 2s – і три 2р-АО; вони заповнюються
На 3-ому рівні розташовуються АО трьох видів: одна Зs-, три 3р – і п’ять 3d-АО. Таким чином, на цьому рівні може розміститися 18 електронів. Однак 3-й період, де заповнюється 3-й енергетичний рівень, закінчується Аргоном, який має на зовнішньому рівні тільки 8 електронів.
У наступного за Аргоном елемента Калію К починає заповнюватися 4-й рівень, і Калій міститься у 4-ому періоді.
Електрон, який додається в атом при зростанні заряду ядра, відчуває, з одного боку, притягання атомним ядром, що змушує електрон займати найнижчий вільний енергетичний рівень,
Саме тому електронна будова Калію така: 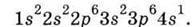 Такий же порядок заповнення АО і рівнів здійснюється у Кальцію.
Такий же порядок заповнення АО і рівнів здійснюється у Кальцію.
Наступне додавання ще одного електрона (у Скандію) зумовлює початок заповнення Зd-АО замість ще більш високих за енергією 4р-АО. Це виявляється енергетично вигіднішим.
Заповнення 3d-Ао закінчується в Цинку, який має електронну будову: 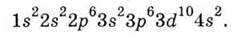
У наступних за цинком елементів відбувається заповнення 4р-АО, і період завершується криптоном, електронна будова якого характеризується вісьмома електронами на зовнішньому рівні: 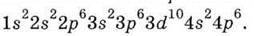
Новий електрон у Рубідію Rb займає 5s-АО 5-ого рівня – починається 5-й період. Розподіл електронів по орбіталях і рівнях в елементів цього періоду відбувається аналогічно, як і в елементів 4-ого періоду.
Таким чином, на відміну від елементів А груп, у яких відбувається поступове заповнення електронами АО зовнішнього рівня, в елементів В груп заповнюються d-АО передостаннього енергетичного рівня. Звідси і назва: d-елементи.
Валентними електронами атомів d-елементів є електрони, які займають d-АО передостаннього і s-АО останнього енергетичних рівнів. Отже, Скандій має три валентних електрони, Титан – чотири і т. д. Це число електронів відповідає номеру групи d-елемента.
Аналогічна ситуація і для елементів А груп, тому елементи А і В груп із рівним числом валентних електронів входять у групу під одним номером.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- ВЛАСТИВОСТІ d-ЕЛЕМЕНТІВ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ВЛАСТИВОСТІ d-ЕЛЕМЕНТІВ Усі прості речовини, утворені елементами В-груп, є металами. Завдяки великому числу валентних електронів і більшого числа АО, ніж в елементів-металів А груп, атоми d-елементів утворюють більшу кількість хімічних зв’язків між собою, тому утворені ними прості речовини мають більш міцну кристалічну гратку. Вона міцніша і механічно, і […]...
- Теоретичне обгрунтування періодичної системи елементів Д. І. Менделєєва ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.8. Теоретичне обгрунтування періодичної системи елементів Д. І. Менделєєва Порядок заповнення електронами енергетичних рівнів (електронних шарів) і підрівнів (підшарів) теоретично обгрунтовує періодичну систему елементів Д. І. Менделєєва. Вже з розгляду електронних […]...
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- ЕЛЕКТРОННА БУДОВА І ВЛАСТИВОСТІ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ 3-ого ПЕРІОДУ Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ЕЛЕКТРОННА БУДОВА І ВЛАСТИВОСТІ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ 3-ого ПЕРІОДУ Електронна будова атомів елементів 3-ого періоду визначається розподілом електронів на трьох енергетичних рівнях. При цьому перші два рівні, найближчі до ядра, заповнені цілком; їх будова описується електронною формулою 1s22s22р6. У періоді зліва направо відбувається поступове заповнення електронами зовнішнього, […]...
- МЕТАЛІЧНІ ВЛАСТИВОСТІ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ МЕТАЛІЧНІ ВЛАСТИВОСТІ Застосування металів як таких базується саме на їх металічних властивостях. Мова йде про металічні властивості речовин, на відміну від металічних властивостей хімічних елементів. Спільним у будові всіх речовин металів є атомна кристалічна гратка і, внаслідок незаповненості електронами зони зв’язуючих молекулярних орбіталей, здатність електронів сприймати і передавати […]...
- Взаємозв’язок між розміщенням елементів у періодичній системі та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном і Оксигеном Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 50 Тема. Взаємозв’язок між розміщенням елементів у періодичній системі та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном і Оксигеном Цілі уроку: розширити знання про взаємозв’язок між розміщенням хімічних елементів у періодичній системі, будовою їхніх атомів та їх фізичними […]...
- РЯД АКТИВНОСТІ МЕТАЛІВ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ РЯД АКТИВНОСТІ МЕТАЛІВ За числовим значенням своєї відновної здатності всі метали можуть бути розташовані в ряд, який називається р я д о м активності мета л і в. Його називають ще електрохімічним рядом, підкреслюючи тим самим, що, вступаючи в хімічну реакцію, метал віддає електрони – носії електричного струму. […]...
- КАЛЬЦІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ КАЛЬЦІЙ Одна з найважливіших сполук кальцію – оксид СаО (негашене вапно). Його одержують розкладом вапняку (що складається, в основному, з карбонату кальцію) при високій (біля 1000 °С) температурі: Це – оксид лужноземельного металу, тому він легко взаємодіє з водою, утворюючи луг – гідроксид кальцію: Технічна назва Са(ОН)2 – […]...
- ВИРОБНИЦТВО ЧАВУНУ І СТАЛІ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ВИРОБНИЦТВО ЧАВУНУ І СТАЛІ Сировиною для одержання заліза є залізні руди, основою яких можуть бути оксид феруму (III) (червоний залізняк) або ферит феруму (II) Fе3O4 (магнітний залізняк, або магнетит, від чого походить назва явища магнетизму). Щоб одержати металічне залізо, його треба відновити. З огляду на величезні масштаби виробництва […]...
- ЗАЛІЗО І ЙОГО СПОЛУКИ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗАЛІЗО І ЙОГО СПОЛУКИ Проста речовина залізо – метал з усіма характерними для металічного стану властивостями: високими тепло – і електропровідністю, ковкістю, “металічним” блиском та ін.; здатний утворювати сплави з іншими металами, а також, що дуже важливо на практиці, і з вуглецем. Від більшості інших металів залізо відрізняється […]...
- АЛЮМІНІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ АЛЮМІНІЙ Алюміній – третій за поширеністю елемент земної кори. Він входить до складу багатьох силікатних мінералів, які називаються алюмосилікатами. Найважливішою природною сполукою алюмінію, що стала сировиною для виробництва металу, є боксит – гідратований оксид алюмінію. Алюміній – дуже активний метал. У ряді активності металів він стоїть лівіше багатьох […]...
- Періодичний закон і періодична система елементів у світлі вчення про будову атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.9. Періодичний закон і періодична система елементів у світлі вчення про будову атомів Вчення про будову атомів розкрило глибокий фізичний зміст періодичного закону. Як зазначалося у § 2.4, головною характеристикою атома […]...
- Будова електронних оболонок атомів і структура Періодичної системи Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок атомів і структура Періодичної системи Число хімічних елементів у періодах Структура Періодичної системи повністю обумовлюється принципами будови електронної оболонки атомів. Число хімічних елементів, що містяться в кожному періоді, визначається місткістю відповідних енергетичних шарів. Число орбіталей на кожному енергетичному […]...
- Збуджений стан атома – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.2. Збуджений стан атома При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі. Так, в атома Сульфуру є вільні d-орбіталі, тому можливий перехід одного зі спарених електронів з 3p-орбіталі […]...
- ОКСИДИ НІТРОГЕНУ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ОКСИДИ НІТРОГЕНУ Позитивну валентність Нітроген виявляє у сполуках з Оксигеном – оксидах. При цьому особливістю Нітрогену є те, що він утворює оксиди, які відповідають усім теоретично можливим валентностям від 1 до 5 (зовнішній енергетичний рівень атома Нітрогену містить п’ять електронів). Відповідно існують наступні оксиди нітрогену: N2O, NO, N2O3, […]...
- БУДОВА АТОМІВ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ Галогенами називаються хімічні елементи VІІА групи. Ця загальна назва походить від грец. “галс” – сіль і “генес” – той, що народжує, тобто “солероди”. У галогенів яскравіше порівняно з іншими елементами виражені властивості неметалів. Кажуть, галогени – типові неметали. БУДОВА АТОМІВ ГАЛОГЕНІВ З галогенів у періодичній системі елементів першим розташований Флуор […]...
- ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ Цілі: на основі знань про періодичну систему елементів і будову атома дати загальну характеристику металічних елементів за їх положенням у періодичній системі й будовою […]...
- Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Хімія Загальна хімія Основні поняття, закони й теорії хімії Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Валентність – це властивість атомів хімічного елемента утворювати хімічні зв’язки з певним числом атомів інших хімічних елементів. За одиницю валентності прийнята валентність атома Гідрогену. Він одновалентний, тобто може утворювати тільки один зв’язок. Кількісне […]...
- Послідовність заповнення електронами енергетичних рівнів та підрівнів – ХІМІЯ Формули й таблиці ХІМІЯ Послідовність заповнення електронами енергетичних рівнів та підрівнів 1s22s22p63s23p64s23d104p65s24d105pe6s25d14f145d2-106p67s2…...
- ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 13. ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) Цілі: повторити положення в ПС, будову атома Феруму, способи добування, фізичні властивості сполук Феруму(ІІ) та Феруму(ІІІ); вміти складати рівняння хімічних реакцій, що ілюструють хімічні властивості заліза, якісне визначення сполук Феруму(ІІ) […]...
- АЗОТ ЯК ПРОСТА РЕЧОВИНА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ АЗОТ ЯК ПРОСТА РЕЧОВИНА Молекула N2 – найміцніша з усіх молекул відомих простих речовин, це – взагалі одна з найміцніших молекул (енергія хімічного зв’язку вища тільки в молекулі СО), тому у природі Нітроген знаходиться, в основному, у вигляді простої речовини N2 – однієї з основних складових частин повітря, […]...
- Будова електронних оболонок та властивості хімічних елементів Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок та властивості хімічних елементів Металічні й неметалічні елементи Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. В атомах елементів головних підгруп валентними е електрони зовнішнього енергетичного рівня. Завершені […]...
- Періодична система хімічних елементів Д. І. Менделєєва Контрольні запитання № 1. Сучасна Періодична система складається з 7 періодів, 8 груп. № 2. Періоди – горизонтальні ряди елементів. Групи – вертикальні стовпчики елементів. № 3. Перші три періоди називають малими, оскільки їх становить невелике число елементів: до першого періоду входять тільки 2 елементи (Гідроген і Гелій), а до другого і третього – по […]...
- Положення металів у періодичній системі елементів Д. І. Менделєєва – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ § 12.1. Положення металів у періодичній системі елементів Д. І. Менделєєва Якщо в періодичній системі елементів Д. І. Менделєєва провести діагональ від берилію до астату, то праворуч угорі від діагоналі будуть елементи-неметали (виключаючи елементи побічних підгруп), а […]...
- ОКИСНЕННЯ – ВІДНОВЛЕННЯ Хімія – універсальний довідник ГАЛОГЕНИ ОКИСНЕННЯ – ВІДНОВЛЕННЯ Суть реакції між металом і галогеном полягає у втраті електронів атомами одного елемента (у даному випадку металу) і приєднанні цих електронів атомами іншого елемента (галогену). Такі реакції називаються окисно-відновними. Процес віддачі електронів називається окисненням; процес приєднання електронів – відновленням. Речовина, що приймає електрони, називається окисником; речовина, що […]...
- Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини ВСТУП Урок 2 Тема уроку. Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини Цілі уроку: узагальнити й систематизувати знання учнів про періодичне повторення властивостей хімічних елементів і речовин, утворених цими елементами; розширити уявлення учнів про будову атома, зв’язок між будовою атомів та їх положенням у періодичній системі; повторити види хімічного […]...
- Електронні формули ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.7. Електронні формули Розподіл електронів в атомі на енергетичних рівнях і підрівнях зображують у вигляді електронних формул. Покажемо, як їх скласти. Кожний електрон в атомі займає вільну орбіталь з найнижчою енергією, […]...
- БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ Лужними металами називаються елементи ІА групи. Якщо галогени є типовими, найяскравіше вираженими неметалами, то елементи ІА групи – це типові метали. БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ З елемента ІА групи розпочинається кожен період у таблиці Д. І. Менделєєва. Це означає, що саме в атомах цих елементів розпочинається заповнення наступного енергетичного […]...
- АМІАК. АМІАЧНА ВОДА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ АМІАК. АМІАЧНА ВОДА Одна з технічно цінних сполук Нітрогену з Гідрогеном – аміак NН3. У промисловості аміак синтезують із простих речовин: азоту (з повітря) і водню. Це – перший етап зв’язування азоту повітря: Реакція синтезу оборотна. Оскільки вона екзотермічна, то підвищення температури зміщує рівновагу вліво. Реакція супроводжується зменшенням […]...
- СУЛЬФУР – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФУР Найважливішою сполукою Сульфуру є сульфатна кислота Н2SO4. У якості сировини для виробництва сульфатної кислоти використовуються самородна сірка, а також Сульфур, одержаний при очищенні від його сполук нафти і газу, а ще – сульфіди. Початкова стадія виробництва незалежно від сировини в принципі однакова – випалювання (нагрівання на повітрі): […]...
- Елементи-метали в Періодичній системі – Метали Хімія Неорганічна хімія Метали Елементи-метали в Періодичній системі Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: – мале число електронів на зовнішньому енергетичному […]...
- СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Окисник – речовина, що містить елемент, у якого в ході реакції ступінь окиснення знижується внаслідок прийому електронів; процес приєднання електронів називається відновленням. Відновник – це речовина, що містить елемент, у якого в ході реакції […]...
- ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ № 1. У періодичній системі хімічні елементи розміщені в пронумерованих клітинках. Номер клітинки кожного хімічного елемента невипадковий – він дорівнює заряду ядра атома. Так заряд ядра атома Оксигену +8 і його порядковий номер теж 8. Кожний елемент у періодичній системі має свій порядковий номер. Він є цілим числом і в кожного наступного елемента збільшується на […]...
- КАТАЛІЗ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ КАТАЛІЗ Швидкість хімічних реакцій визначається, насамперед, природою реагуючих речовин. Змінити природу реагентів не можна. Але можна використовувати якусь речовину, яка взаємодіє з вихідними речовинами за більш низьких температур з утворенням нестійкої сполуки (проміжного продукту), з якої потім утворюється необхідний продукт реакції. Такий спосіб проведення реакції, що полегшує і […]...
- Основні закономірності Зміни властивостей елементів ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 5. Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва Пошуки основ для класифікації хімічних елементів почалися доволі давно. На момент відкриття періодичного закону Д. І. Менделєєвим (1834-1907) і створення першого варіанта періодичної системи – 1 березня 1869 р. – було відомо […]...
- Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.5. Загальна характеристика підгрупи галогенів Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не […]...
- Загальна характеристика – Урок 4 – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.1. Загальна характеристика До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві. Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи: Валентність Нітрогену […]...
- ФОСФОР I ЙОГО СПОЛУКИ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ФОСФОР I ЙОГО СПОЛУКИ Радіус атома Фосфору майже у два рази більший, ніж Нітрогену. Це зумовлює суттєві відмінності у їхніх властивостях. Різниця в розмірах атомів позначається уже в будові простих речовин. Молекули азоту, утворені маленькими атомами, двохатомні. Збільшення розміру атомів веде до менш ефективного перекривання їх атомних орбіталей […]...
- ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ХІМІЧНА РІВНОВАГА Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює Швидкості його розкладання на SO2 і O2: За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту […]...