Добування кисню. Реакція розкладу
Тема 2 Кисень
& 17. Добування кисню. Реакція розкладу
Опанувавши цю тему, ви зможете:
– знати реакції, які взято за основу добування кисню в лабораторії та промисловості, способи збирання кисню і реакції розкладу;
– складати рівняння реакцій добування кисню;
– формулювати визначення реакції розкладу, каталізатора і розуміти їхню суть;
– досліджувати наявність кисню;
– формувати здатності до оволодіння хімічною мовою.
З історії відкриття. Вам уже відомо, що кисень відкривали тричі. Англійський хімік
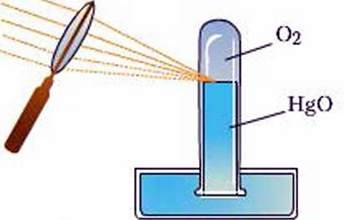
Рис. 60. Прилад, за допомогою якого Дж. Прістлі добув кисень
Добування кисню в лабораторії. Про один з лабораторних способів добування кисню вам уже
Реакцію розкладу меркурій(ІІ) оксиду в уже згадуваному експерименті можна записати рівнянням
T
2HgO = 2Hg + О2,
Де t означає, що реакція відбулася за нагрівання.
Реакцію, описану в досліді Дж. Прістлі, не проводять у шкільних умовах через високу токсичну дію парів ртуті. Проте існує багато інших оксигеновмісних речовин, здатних розкладатися з виділенням кисню. До них належать: гідроген пероксид Н2О2, калій хлорат КСlО3, натрій нітрат NaNO3, калій нітрат KNO3, вoда Н2O, калій перманганат КМnО4 (марганцівка) тощо.
Досить безпечним і доступним у лабораторних умовах є добування кисню розкладом гідроген пероксиду.
Дослід 1. Наллємо в пробірку гідроген пероксиду Н2О2 (рис. 61), умонтуємо її в лапку штатива, а кінець газовідвідної трубки опустимо в циліндр для збирання кисню. Нагріємо обережно пробірку з умістом і перевіримо па наявність кисню. Кисень не виділяється.
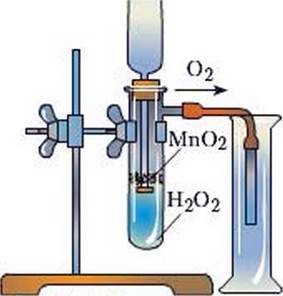
Рис. 61. Добування кисню розкладом гідроген пероксиду
Видозмінимо дослід. У пробірку з гідроген пероксидом додамо трохи манган(ІV) оксиду. У циліндрі збирається газ кисень.
Наявність газу перевіримо тліючою скіпкою. Якщо опустити її в циліндр, вона спалахує яскравим полум’ям і горить.
– Яким способом, на вашу думку, збирали кисень?
Чому реакція відбувається швидко у випадку, коли до реагенту додати чорного порошку манган(IV) оксиду? Останній проявляє здатність прискорювати перебіг хімічного перетворення, але сам залишається незмінним. Рівняння реакції:
T, МnO2
2Н2O2 = 2H2O + O2↑
Речовини, що прискорюють хімічні реакції, але не витрачаються, називають каталізаторами.
Реакції, що відбуваються за участю каталізаторів, називають каталітичними. Каталітичною є і реакція добування кисню з калій хлорату за нагрівання:
T, МnO2
2КСlO3 = 2КСl + 3O2↑
У живих організмах теж містяться каталізатори, що прискорюють хімічні реакції в їхніх клітинах. Такі каталізатори
Називають ферментами. Вони беруть участь в усіх біологічних перетвореннях. Дію ферментів спостерігають під час виготовлення сиру, випікання хліба, виробництва вин тощо.
Під дією постійного електричного струму вода теж розкладається на два гази – кисень і водень:
Ел. струм
2Н2О = 2H2 + О2↑
Способи збирання кисню. У хімічних лабораторіях застосовують два способи збирання кисню: витісненням повітря і води. З першим способом ви ознайомилися під час добування кисню з гідроген пероксиду. Його застосовують, ураховуючи те, що кисень є важчим за повітря, тому й може витіснити повітря з посудини, у яку його збирають. Другий спосіб грунтується па властивості кисню дуже слабо розчинятися у воді (рис. 62).
У промисловості кисень добувають з повітря. Основним завданням є відділити його від інших газів, зокрема від азоту. З цією метою повітря під тиском зріджують, а потім поступово підвищують температуру. За температури -196 °С азот випаровується. Кисень за таких умов залишається в рідкому стані. Газуватий кисень зберігають під високим тиском у сталевих балонах, які за будовою подібні до термоса.
Окрім цього способу, кисень у промисловості добувають з води. Вода розкладається на кисень і водень, якщо пропускати крізь неї постійний електричний струм. Таку реакцію називають електролізом водню.
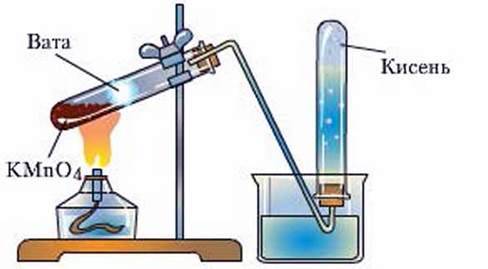
Рис. 62. Збирання кисню витісненням води
Електроліз води можна застосувати також для добування водню (див. реакцію вище).
Реакції розкладу. Реакції добування кисню в лабораторії характеризуються тим, що з однієї речовини добувають дві й більше інших сполук. Такий тип реакцій у хімії називають реакціями розкладу.
Реакції розкладу – це реакції, під час яких з однієї складної речовини утворюється кілька простіших за складом речовин.
– Поміркуйте, про що говорить сама назва типу реакцій?
Дуже ефектною реакцією розкладу є дослід “хімічний вулкан”. У фарфоровій ступці розтирають оранжево-червоні кристали амоній дихромату (NН4)2Cr2O7. Висипають сіль на металеву пластинку, надаючи їй форми гірки. У вершину гірки вставляють дві-три головки сірників і запалюють їх. Від тепла, що виділяється палаючими сірниками, починає бурхливо розкладатися амоній дихромат. Із “кратера вулкана” викидається сніп яскравих іскор. Гірка помітно збільшується від утвореного під час реакції хром(III) оксиду темно-зеленoго кольору. Об’єм продуктів реакції є більшим за об’єм реагента. Увесь процес нагадує виверження вулкана (риc. 63). Рівняння цієї реакції (не для запам’ятовування):
(NH4C)2СrO7 = N2 + 4H2О + Сr2О3

Рис. 63. Хімічний вулкан
Реакції розкладу відіграють важливу практичну роль у житті людини. До них належать: реакція випалювання вапняку, схема СаСО3 -> СаО + СО2↑, за якою в промисловості добувають погашене вапно СаО; реакція розкладу амоній карбонату (порошку до печива), яку можна зобразити схемою (NH4)2CО3 → NH3↑+ CO2↑+ Н2О, тощо.
Перепишіть ці схеми в робочий зошит і перетворіть їх на рівняння реакцій.
Численні реакції розкладу постійно відбуваються в нашому організмі, завдяки чому вивільняється багато енергії, необхідної для роботи всіх органів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
– У лабораторії кисень добувають за допомогою реакцій розкладу речовин, що містять Оксиген: гідроген пероксиду Н2О2; калій хлорату КСІО3; калієвої чи натрієвої селітри, відповідно KNO3 чи NaNO3 тощо. У промисловості – дистиляцією повітря за відповідних температур і тиску.
– Реакції розкладу – реакції, під час яких з однієї складної речовини утворюється декілька простіших за складом речовин. Реакції розкладу мають велике практичне значення для життєдіяльності організмів і добробуту людини.
– Речовини, що прискорюють хімічні реакції, але не витрачаються, називають каталізаторами.
ЦІКАВО ЗНАТИ
– У промисловому виробництві застосовують понад 400 каталітичних реакцій.
– Ферменти використовують у фармацевтичній промисловості, виробництві синтетичних мийних засобів, маргарину тощо.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Поясніть на прикладах, що вам відомо про перші лабораторні спроби добування кисню.
2. Перетворіть схеми на відповідні рівняння реакцій:
T ел. струм t, MnCO2
А) Аg2О -> Аg + O2↑; б) Н2О -> Н2 + О2↑; в) Н2О2 -> Н2О + O2↑.
3. Допишіть пропущені формули. Складіть рівняння реакцій:
T t, MnO2
A) NaNO3-> NaNO2 + ?↑; б) NO2 -> NO + ?; в) KClO3->? + O2↑.
4. Допишіть продукти й перетворіть схеми на рівняння реакцій:
T
А) Н2O2 -> ? + ?; б) Н2O -> ? + ?; в) NaNO3 -> NaNO2 + ?↑.
ДОСЛІДЖУЄМО ВДОМА
Для експерименту використайте розчин гідроген пероксиду з масовою часткою розчиненої речовини 3 %. Цей розчин є в кожній домашній аптечці.
Покладіть на блюдце сирі й відварені холодні картоплю, моркву. буряк, м’ясо, сир. Крапніть розчином гідроген пероксиду на кожний з них. Спостерігайте, як поводить себе гідроген пероксид. Опишіть ваші спостереження.
