Естери. Жири. Мило. Реакція естерифікації. Склад, хімічна будова естерів. Гідроліз естерів
II Семестр
Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 41
Тема уроку. Естери. Жири. Мило. Реакція естерифікації. Склад, хімічна будова естерів. Гідроліз естерів
Цілі уроку: формувати знання учнів про естери; поглибити знання учнів про хімічні властивості кислот і спиртів на прикладі реакції естерифікації, показати практичне значення цієї реакції; вивчити умови зсуву хімічної рівноваги на прикладі реакції естерифікації; розглянути поширення естерів у природі, галузі їх використання.
Тип уроку: вивчення нового матеріалу.
Форми
Демонстрація 9. Одержання естеру.
Демонстрація 10. Ознайомлення зі зразками естерів.
Обладнання: презентації учнів про природні джерела естерів.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності
1. Фронтальна бесіда
¦ Зобразіть електронну схему будови алканолу, карбонової кислоти.
¦ Напишіть реакцію міжмолекулярної дегідратації 1-пропанолу.
¦ Напишіть рівняння реакції між етанолом і пропановою кислотою в присутності сульфатної кислоти.
2. Галузь
III. Вивчення нового матеріалу
1. Естери
Естери – це сполуки із загальною формулою R – COOR’, де R і R’ – вуглеводневі радикали.
Естери можна одержати в результаті взаємодії карбонових кислот зі спиртами (реакція естерифікації). Каталізаторами є мінеральні кислоти.
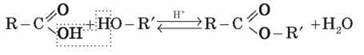
Ця реакція є оборотною. Зворотний процес – розщеплення естеру внаслідок дії води з утворенням карбонової кислоти та спирту – називають гідролізом естеру.
Демонстрація 9. Одержання естеру
Збираємо установку для одержання естеру з оцтової кислоти й етилового спирту.
Демонстрація 10. Ознайомлення зі зразками естерів
Розглядаємо зразки естерів, дотримуючись правил техніки безпеки, досліджуємо фізичні властивості естерів (колір, запах).
2. Номенклатура естерів
Назва естеру утворюється від назв кислоти та спирту, що були використані для реакції естерифікації. Спочатку називається кислота, потім – прикметник від назви спирту з додаванням слова “естер”.
За сучасною міжнародною номенклатурою назви естерів складають з назви вуглеводневого радикала, що відповідає спирту, і кореня латинської назви кислоти з додаванням суфікса – ат.
Наприклад, H – COO – C2H5 – етилформіат (етиловий естер мурашиної кислоти).
Назвіть естери:
– CH3 – COO – C2H5 – етилацетат (етиловий естер оцтової кислоти);
– C3H7 – COO – CH3 – метилбутират (метиловий естер бутанової кислоти);
– C2H5 – COO – C3H7 – пропілпропіонат (пропіловий естер пропанової кислоти).
3. Гідроліз і омилення естерів
Гідроліз за присутності лугу відбувається необоротно (оскільки негативно заряджений карбоксилат-аніон RCOO-, що при цьому утворюється, не вступає в реакцію з нуклеофільним реагентом – спиртом).
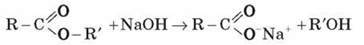
Ця реакція називається омиленням естеру.
Запишіть реакцію омилення етилового естеру гексанової кислоти.
Естери нижчих карбонових кислот і нижчих одноатомних спиртів мають приємний запах квітів, ягід і фруктів. Естери вищих одноосновних кислот і вищих одноатомних спиртів – основа природних восків. Наприклад, бджолиний віск містить естер пальмітинової кислоти й мірицилового спирту (мірицилпальмітат)
CH3(CH2)14 – CO – OCH2(CH2)29CH3.
4. Повідомлення учнів про естери, їх застосування в харчовій і парфумерній галузях промисловості
Приклад повідомлення
– Пентиловий естер оцтової кислоти використовується для виготовлення бананової есенції (речовини, що має запах банана);
– ізопентиловий естер оцтової кислоти має запах груші;
– метиловий естер масляної кислоти – яблука;
– етиловий естер масляної кислоти – ананаса;
– ізопентиловий естер масляної кислоти – сливи;
– пентиловий естер мурашиної кислоти – вишні.
IV. Первинне застосування одержаних знань
1. Напишіть рівняння реакції естерифікації:
А) мурашиної кислоти 1-бутанолом;
Б) 2-пропанолу й оцтової кислоти;
В) етанолу й акрилової кислоти.
2. Розв’яжіть задачі.
А) Обчисліть об’єм етанолу (густина – 0,8 г/мл), необхідний для одержання 120 г етилового естеру масляної кислоти.
Б) Обчисліть масу метилацетату, що її можна одержати в результаті взаємодії метанолу масою 16 г і етанової кислоти масою 27 г.
3. Складіть схему одержання оцтовоетилового естеру з етану. За схемою напишіть рівняння реакцій.
V. Підбиття підсумків уроку
Оцінювання роботи учнів на уроці.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати повідомлення або презентації про біологічну роль жирів.
