Фізичні й хімічні властивості оксидів
Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 16
Тема. Фізичні й хімічні властивості оксидів
Цілі уроку: ознайомити учнів з фізичними й хімічними властивостями оксидів; дати поняття індикаторів, пояснити їх використання для визначення кислот та основ; розвивати логічне мислення учнів на прикладі порівняння взаємодії кислотних і основних оксидів з водою, кислотами, лугами, іншими оксидами; розвивати вміння й навички складати рівняння хімічних реакцій на прикладі хімічних властивостей оксидів.
Тип уроку: формування вмінь
Форми роботи: фронтальна робота, розповідь учителя, демонстраційний експеримент.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, хімічні реактиви.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
– Ми знаємо, що за складом хімічні сполуки поділяються на чотири класи. Які саме? (Оксиди, основи, кислоти, солі)
– Як розрізняють класи сполук? (За складом речовин)
– А якщо формула речовини не відома? (То розпізнати її можна за хімічними властивостями)
III. Формування вмінь і навичок
Демонстрація 2. Взаємодія
Не всі оксиди тверді.
– Наведіть приклади газоподібних оксидів. (CO, СO2, SO2)
Відрізняються оксиди:
– за забарвленням: СuО – чорний; Сu2O – червоний, Fe2O3 – бурий, Сr2O3 – зелений тощо;
– за температурою плавлення;
– за розчинністю у воді (CuO, Fe2O3 – нерозчинні у воді; СаО й Р2O5 – розчинні).
Розчинні оксиди взаємодіють із водою.
– Які продукти виходять у результаті такої взаємодії?
Дослід 2. У склянку з водою насипаємо білий порошок СаО, а в іншу – білий порошок Р2O5.
– Що спостерігаємо? Обидва порошки розчинилися у воді.
– Що сталося з водою?
Розібратися в цьому нам допоможе індикатор – речовина, що реагує на різне середовище зміною забарвлення. Познайомимося з двома з них. Фенолфталеїн – безбарвний у нейтральному й кислому середовищі, стає малиновим у лужному середовищі. Додаємо дві краплі фенолфталеїну в розчин СаО – з’являється малинове забарвлення, а в розчині Р2O5 колір не змінився.
Метиловий оранжевий у нейтральному середовищі – оранжевий, у лужному – жовтий, у кислому – червоний.
Додаємо по кілька крапель у наші розчини:
Розчин СаО під дією метилового оранжевого забарвився в жовтий колір, отже, у склянці міститься луг;
Розчин Р2O5 набув червоного забарвлення, отже, у цій склянці міститься кислота.
Запишемо рівняння реакцій, щоб підтвердити наші дослідження.
СаО + Н2O = Са (ОН)2 (кальцій гідроксид)
Р2O5 + 3Н2O = 3Н3РO4 (ортофосфатна кислота)
Висновок. Кислотні оксиди в результаті взаємодії з водою утворюють кислоти, а основні оксиди утворюють основи.
По-різному кислотні й основні оксиди взаємодіють із лугами й кислотами. Розглянемо на прикладах:
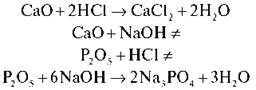
Висновок. Кислотні оксиди взаємодіють з основами з утворенням солі й води; основні оксиди взаємодіють із кислотами з утворенням солі й води.
Кислотні й основні оксиди можуть взаємодіяти між собою.
СаO + Р2O5 = Са3(РO4)2
IV. Закріплення вивченого матеріалу
Заповнюємо опорну схему “Хімічні властивості оксидів”, по ланцюжку на дошці складаємо рівняння реакцій з опорної схеми.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи.
Творче завдання. Підготувати повідомлення про використання оксидів.
