Фізичні та хімічні явища (хімічні реакції). Хімічні властивості речовин
Розділ 1 Початкові хімічні поняття
17 Фізичні та хімічні явища (хімічні реакції). Хімічні властивості речовин
Матеріал параграфа допоможе вам:
> з’ясувати відмінності фізичних і хімічних явищ (хімічних реакцій);
> зрозуміти роль хімічних реакцій у природі, їхнє значення для людини;
> вирізняти хімічні властивості речовин.
На уроках природознавства ви дізналися, що в природі відбуваються різні фізичні та хімічні явища.
Фізичні явища. Кожний із вас спостерігав за тим, як тане лід, кипить або замерзає вода. Лід,
Явища, під час яких речовини не перетворюються на інші, називають фізичними.
До фізичних явищ належать не лише зміни агрегатного етапу речовин, а й світіння сильно нагрітого металу або каменю, проходження електричного струму в металах, поширення запаху речовин у повітрі, розчинення жиру в бензині, притягання заліза до магніту тощо. Такі явища вивчає наука фізика.
Хімічні явища (хімічні реакції). Одним із хімічних явищ є горіння. Розглянемо, як горить спирт (мал. 48). Цей процес відбувається

Мал. 48. Горіння етилового спирту
Явища, під час яких одні речовини перетворюються на інші, називають хімічними явищами, або хімічними реакціями.
Речовини, що вступають у хімічну реакцію, називають вихідними речовинами, або реагентами, а ті, що утворюються, – кінцевими речовинами, або продуктами реакції.
Суть розглянутої хімічної реакції передає такий запис:
Спирт + кисень -> вода + вуглекислий газ.
Вихідні речовини кінцеві речовини
(реагенти) (продукти реакції)
Реагенти і продукти цієї реакції складаються з молекул. Під час горіння створюється висока температура. За цих умов молекули реагентів розпадаються на атоми, які, сполучаючись, утворюють молекули нових речовин – продуктів1. Отже, всі атоми під час реакції зберігаються.
Зовнішні ефекти, що супроводжують хімічні реакції. Спостерігаючи за перебігом хімічних реакцій, можна зафіксувати:
– появу, зникнення чи зміну забарвлення (мал. 49, а);
– виділення газу (мал. 49, б);
– утворення чи розчинення осаду (мал. 49, в);
– появу, зникнення чи зміну запаху;
– виділення чи поглинання теплоти;
– появу полум’я (мал. 48), іноді – світіння.
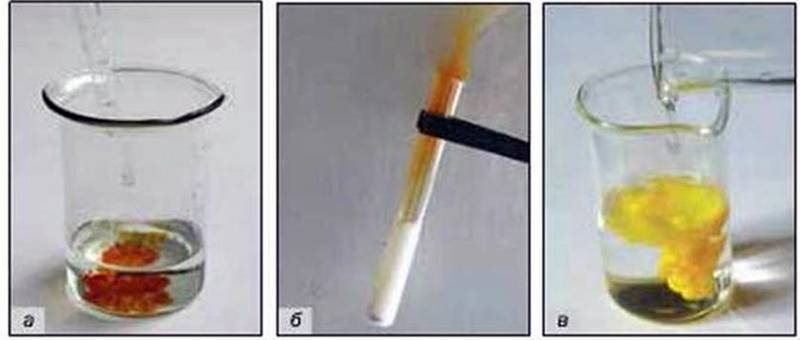
Мал. 49. Зовнішні ефекти під час хімічних реакцій:
А – поява забарвлення; б – виділення газу; в – утворення осаду
1Відомі й інші варіанти взаємодії частинок реагентів.
ЛАБОРАТОРНИЙ ДОСЛІД № З
Проведення хімічних реакцій
Вам видано розчини кальцинованої соди і фенолфталеїну. Чи мають вони забарвлення? Налийте в пробірку 1 мл розчину соди і додайте 1-2 краплі розчину фенолфталеїну. Що спостерігаєте?
Налийте у дві пробірки по 1 мл розчину соди. В одну пробірку додайте 1 мл розбавленої нітратної кислоти, а в другу – 1 мл розчину мідного купоросу. Що відбувається в кожній пробірці?
Указані на попередній сторінці зовнішні ефекти, крім появи полум’я, можна спостерігати й під час фізичних явищ.
Приклад 1. Порошок срібла, добутий у пробірці внаслідок хімічної реакції, має сірий колір. Якщо його розплавити, а потім розплав охолодити, то отримаємо злиток металу, але не сірого, а білого кольору, з характерним блиском.
Приклад 2. Якщо нагрівати природну чи водопровідну воду, то з неї задовго до кипіння почнуть виділятися маленькі пухирці газу. Це – повітря, яке містилось у воді. Його розчинність у воді, як і будь-якого газу, зі збільшенням температури зменшується.
Приклад 3. Неприємний запах у холодильнику зникає, якщо в нього помістити гранули силікагелю – однієї зі сполук Силіцію. Силікагель вбирає молекули різних речовин без їх руйнування. Аналогічно діє активоване вугілля у протигазі.
Приклад 4. При перетворенні води на пару поглинається теплота, а при замерзанні води – виділяється.
Щоб визначити, яке явище відбувається – фізичне чи хімічне, слід уважно спостерігати за ним, а також ретельно дослідити речовини до і після проведеного експерименту.
Цікаво знати
Щороку в рослинах утворюється 160 млрд. т органічних речовин.
Хімічні реакції в природі, повсякденному житті та їх значення. У природі постійно відбувається безліч хімічних реакцій. Багато речовин, розчинених у річках, морях і океанах, взаємодіють між собою, деякі реагують із киснем. Рослини вбирають з атмосфери вуглекислий газ, із грунту – воду, розчинені в ній речовини і переробляють їх на білки, жири, глюкозу, крохмаль, вітаміни, інші сполуки, а також кисень. Надзвичайно важливими є реакції за участю кисню, який потрапляє в живі організми при диханні.
Багато хімічних реакцій ми здійснюємо в побуті. Вони відбуваються під час смаження м’яса, овочів, випікання хліба, скисання молока, бродіння плодових і ягідних соків, вибілювання тканин, горіння різних видів палива, тверднення цементу й алебастру, почорніння з часом срібних прикрас тощо.
Хімічні реакції становлять основу багатьох технологічних процесів – добування металів, виробництва синтетичних волокон, ліків, добрив, інших важливих речовин. Спалюючи паливо, люди забезпечують себе теплом і електричною енергією. За допомогою хімічних реакцій знешкоджують токсичні речовини, переробляють промислові та побутові відходи.
Разом із тим перебіг деяких реакцій призводить до негативних наслідків. Іржавіння заліза скорочує термін роботи різних механізмів, обладнання, транспортних засобів, зумовлює великі втрати цього металу. Пожежі знищують житло, промислові та культурні об’єкти, історичні цінності, лісові масиви. Більшість харчових продуктів псується внаслідок їх взаємодії з киснем повітря. При цьому утворюються речовини, що мають неприємний запах, смак і є шкідливими для людини.
Хімічні властивості речовини. Кожній речовині притаманна сукупність різних властивостей.
► Пригадайте, які властивості називають фізичними. Наведіть відповідні приклади.
Крім фізичних властивостей, речовини мають і хімічні властивості. Серед них – здатність вступати в хімічні реакції з певними простими і складними речовинами, інертність щодо інших речовин, термічна стійкість або здатність до хімічного перетворення під час нагрівання.
Розглянемо деякі хімічні властивості води. За звичайних умов і наявності повітря (кисню) вона повільно взаємодіє із залізом (цей процес називають іржавінням). Але вода не реагує з крейдою, піском. Її молекули починають руйнуватися лише при дуже сильному нагріванні (значно вище за 1000 °С). Унаслідок цієї хімічної реакції водяна пара перетворюється на два гази – водень і кисень.
Деякі речовини (наприклад, метал натрій, неметал фтор) називають хімічно активними. Вони взаємодіють з багатьма речовинами. Такі реакції нерідко супроводжуються займанням або вибухом. Існують і хімічно пасивні речовини. Золото за жодних умов не взаємодіє з водою, киснем, оцтом, розчинами харчової та кальцинованої соди, а газ гелій взагалі не вступає в хімічні реакції.
Хімічні властивості речовини залежать від її складу і внутрішньої будови.
ВИСНОВКИ
Фізичними явищами називають явища, під час яких кожна речовина зберігається.
Хімічні явища, або хімічні реакції, – це перетворення одних речовин па інші. Вони можуть супроводжуватися різними зовнішніми ефектами.
Безліч хімічних реакцій відбувається в навколишній природі, живих організмах. На перетвореннях речовин грунтуються різні технологічні процеси.
Кожна речовина мас хімічні властивості, які полягають в її здатності вступати в певні хімічні реакції.
125. Знайдіть відповідність:
Явище
1) вибух динаміту;
2) тверднення розплавленого парафіну;
3) підгоряння їжі на сковороді;
4) утворення солі при випаровуванні морської води;
5) розшарування струшеної суміші води та олії;
6) вицвітання забарвленої тканини на сонці;
Тип явища
А) фізичне явище;
Б) хімічне явище.
126. Якими зовнішніми ефектами супроводжуються такі хімічні перетворення:
А) горіння сірника;
Б) іржавіння заліза;
В) бродіння виноградного соку?
127. Як ви думаєте, чому одні харчові продукти (цукор, крохмаль, оцет, сіль) можуть зберігатися протягом необмеженого часу, а інші (сир, вершкове масло, молоко) швидко псуються?
128. Мінерал малахіт має синьо-зелений колір, не розчиняється у воді, при нагріванні не плавиться, а перетворюється на чорну тверду речовину, виділяючи вуглекислий газ і водяну пару. Які властивості мінералу є фізичними, а які – хімічними?
НА ДОЗВІЛЛІ
Зміна кольору під час хімічної реакції
У дві невеликі склянки налийте трохи води і в кожну додайте 1-2 краплі спиртового розчину брильянтового зеленого (побутова назва цього розчину – зеленка). У першу склянку додайте кілька крапель водного розчину амоніаку (нашатирного спирту), у другу – розчину лимонної кислоти. Чи змінюється колір рідин у склянках? Якщо так, то як саме?
Результат досліду запишіть у зошит і зробіть висновки.
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Взаємодія харчової соди з лимонною кислотою, соком квашеної капусти, кефіром
1. Приготуйте невеликі кількості водних розчинів лимонної кислоти і харчової соди. Злийте разом частини обох розчинів в окрему склянку. Що відбувається?
До залишку розчину лимонної кислоти додайте трохи порошку соди, а до залишку розчину соди – трохи кристаликів лимонної кислоти. Які ефекти спостерігаєте – такі самі, що й при зливанні розчинів, чи інші?
2. Налийте в одну маленьку склянку трохи соку квашеної капусти, а в іншу – нежирного кефіру або сироватки. В обидві склянки додайте по 1/4 чайної ложки харчової соди. Що спостерігаєте?
Виявлені зовнішні ефекти зумовлені хімічними реакціями, що відбулися під час експериментів.
ПРАКТИЧНА РОБОТА № З
Дослідження фізичних і хімічних явищ
Перед виконанням практичної роботи уважно прочитайте правила роботи і безпеки в хімічному кабінеті (с. 17, 28). Ви повинні чітко їх дотримуватися.
Будьте обережними з вогнем.
ДОСЛІД 1
Помістіть у пробірку невелику кількість мідного купоросу (речовина має вкрити дно пробірки) і додайте З-4 мл води. Вміст пробірки перемішуйте скляною паличкою до повного розчинення речовини. Однаковий чи різний колір мають мідний купорос і його розчин?
Половину розчину перелийте в маленьку порцелянову чашку і поставте її на кільце лабораторного штатива. Запаліть спиртівку чи сухе пальне й обережно випарюйте розчин до виділення з нього перших кристаликів речовини. Зіставте їх і мідний купорос за кольором.
Які фізичні явища відбувалися під час виконання досліду? Чи відбулося хімічне явище? Відповідь обгрунтуйте.
ДОСЛІД 2
У пробірку із другою частиною розчину мідного купоросу додайте кілька залізних ошурків1. Якого кольору набуває їхня поверхня? Який метал має такий колір?
Вміст пробірки періодично перемішуйте скляною паличкою до повної зміни забарвлення розчину. Якого кольору він набув?
Повільно перелийте розчин у маленьку порцелянову чашку (тверді речовини мають залишитись у пробірці). Обережно випарте розчин досуха2. Який колір твердого залишку? Про що він свідчить?
Чи відбулося хімічне явище в досліді 2? Відповідь обгрунтуйте.
Під час виконання кожного досліду записуйте в таблицю свої дії, спостереження, а після його завершення – висновки.
№ досліду | Послідовність дій | Спостереження | Висновки |
1 | Розчиняю у воді мідний купорос. … | Утворюється розчин… кольору. … | |
2 |
1 Замість ошурків можна взяти залізні кнопки, скріпки, цвяхи.
2 Можна випарити кілька крапель розчину на предметному склі.
?
129. Чи відбувалися фізичні явища під час виконання досліду 2? Якщо так, то які саме?
130. Як можна довести за допомогою магніту, що в досліді 2 на поверхні заліза утворюється інший метал?
ДЛЯ ДОПИТЛИВИХ
Фізичні та хімічні явища при виведенні плям
Поява плями на одязі або скатертині – завжди неприємна подія. Тільки-но помічаємо пляму, одразу міркуємо, як її позбутися. Можна скористатися послугою спеціалізованого підприємства або спробувати вивести пляму самому.
Пляму від жиру зазвичай видаляють органічним розчинником – бензином, петролейним ефіром, ацетоном. Свіжу жирну пляму можна посипати нагрітим крохмалем, а потім його струсити. Під час цих процедур відбуваються фізичні явища: у першому випадку жир розчиняється в рідині й видаляється з тканини, а в другому – поглинається часточками крохмалю. Деякі нежирові плями вдається змити водою.
Вивести плями від ягід, овочів, напоїв допоможуть засоби побутової хімії. Вони містять речовини, які вступають у реакції з барвниками і знебарвлюють їх. Можна також застосувати сік лимону, розчини лимонної кислоти, гідроген пероксиду (або перекису водню), амоніаку (нашатирний спирт), які теж спричиняють хімічні перетворення багатьох забарвлених речовин.
Важливо перед виведенням плями перевірити, чи не зіпсує обраний засіб саму тканину. Використовуючи органічний розчинник, слід пам’ятати про його вогненебезпечність.
