Фосфор – Елементи VA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.4. Елементи VA групи
9.4.9. Фосфор
Фосфор – 15-й елемент періодичної таблиці, заряд ядра – +15. Хімічний символ – Р, відносна атомна маса – 31. У вільному стані у природі не трапляється. Штучно добутий фосфор у вільному стані утворює понад 10 алотропічних модифікацій, головними з яких є фосфор білий, червоний і чорний.
Електронна формула атома Фосфору – 15Р 1s22s22p63s23p3. Виявляє
Ступінь окиснення | -3 | 0 | +1 | +3 | +5 |
Приклад сполуки | РН3, Mg3P2, Na3P | Р4, Р | Н3РO2, КН2РO2 | Н3РO3, К2НРO3, P2O3, P2S3,РСl3 | Н3РO4, РСl5, К3РO4, Р2О5, P2S5 |
Поширеність Фосфору в природі
У земній корі міститься близько 0,1 % Фосфору (за масою), відомо понад 190 мінералів, що містять Фосфор. Найважливіші серед них фосфорити Са3(РO4)2 (осадові породи, які містять Р205) та апатити Ca5(PO4)3(F, Сl, ОН)2. Значну кількість
Фосфор – біогенний елемент, в організмі людини його близько 1,5 кг. Кальцій ортофосфат Са3(РO4)2 входить до складу кісткової тканини, зумовлюючи її міцність; також входить до складу білків, фосфоліпідів, нуклеотидів (АТФ, ДНК, РНК), коферментів (ФАД, ФМН, НАД+, НАДФ+) усіх живих організмів.
Добування фосфору
В електропечах фосфорити відновлюють вуглецем у суміші з піском за температури 1600 °С без доступу кисню:
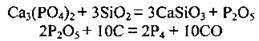
Або сумарне рівняння:
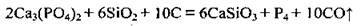
Фізичні властивості фосфору
Найважливішими алотропічними модифікаціями є білий і червоний фосфор.
Білий фосфор – біла аморфна речовина з жовтуватим відтінком, м’яка, легкоплавка (воскоподібна). Має молекули тетраедричної будови Р4:
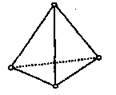
Білий фосфор дуже токсичний – смертельна доза становить 0,05 г. На повітрі повільно окислюється і при цьому світиться (це явище називають хемілюмінесценцією). У воді не розчиняється (саме тому його зберігають у воді), але добре розчиняється у сірковуглеці (карбон(ІV) сульфіді) CS2. Температура плавлення – +44,1 °С, кипіння – +237 °С. У рідкому, розчиненому і пароподібному станах (до 800 °С) складається з молекул Р4. Під час нагрівання до 500 °С без доступу кисню переходить у червоний фосфор.
Червоний фосфор – стійкіша і значно менш токсична, порівняно з білим фосфором, модифікація. Має атомні кристалічні гратки. Це неорганічний полімер Рn зі складною структурою:
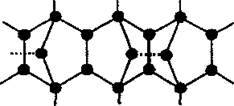
Це і є основною причиною відмінностей його властивостей у порівнянні з білимо фосфором: для червоного явище хемілюмінесценції не властиве, на повітрі повільно окислюється, спалахує при ударі, терті, що використовують у виготовленні сірників.
Хімічні властивості фосфору
У хімічних реакціях фосфор виступає і як окисник, і як відновник.
1. Взаємодія з простими речовинами:
– як відновник з киснем, сіркою і галогенами:
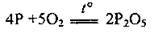
Чи при повільному окисненні або нестачі кисню 02 може утворитися фосфор(ІІІ) оксид Р2O3; аналогічно відбуваються реакції з галогенами і сіркою:
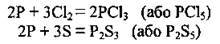
З йодом утворюється лише РІ3:
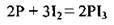
– як окисник з активними металами (фосфор окислюється до найнижчого ступеня окиснення – -3):
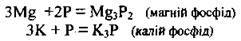
Фосфіди розкладаються водою і кислотами, утворюючи летку сполуку з Гідрогеном – фосфін:
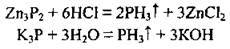
2. Фосфор виявляє відновні властивості у реакціях з деякими кислотами (сильними окисниками), водяною парою, бертолетовою сіллю КСlO3:
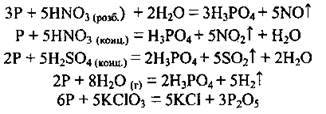
Остання реакція відбувається при запалюванні сірника (головка сірника містить КСlО3 з домішками К2Сr2O7, S, МnO2, а стінка коробки – 31 % фосфору).
Застосування фосфору
Значну частину Фосфору витрачають на добування фосфор(У) оксиду й ортофосфатної кислоти, з якої одержують мінеральні добрива та інші важливі фосфоровмісні речовини: медикаментозні засоби, засоби боротьби зі шкідниками рослин, вибухові речовини. Фосфор використовують у виробництві сірників.
____________________________________________________________
1 Використання мінеральних добрив, попри підвищення врожаїв, несе із собою багато ризиків: це вже згадуване засолення грунтів (див. главу 8.2.4. Калійні добрива), а також евтрофікація водойм. Евтрофікацією називають насичення водойм рослинними біогенами (які містять насамперед Фосфор і Нітроген), що спричиняє бурхливий ріст фітопланктону (синьо-зелених водоростей) у поверхневій плівці (“цвітіння” води), дефіцит кисню, загибель водяних рослин і замор риби та інших водяних тварин, зараження води хвороботворними мікроорганізмами. Так, щорічні замори на Чорному й Азовському морях відбуваються не внаслідок викиду на поверхню глибинного сірководню (як вважалось раніше), а саме в результаті діяльності людини. Мінеральні добрива змиваються з полів, потрапляють у підземні води, прісноводні водойми: озера й ріки (Дніпро, Дністер, Дон), а потім – і в моря.
2 Мінерали класу фосфатів непостійного складу можуть містити домішки Феруму, Мангану, Алюмінію, Торію, рідкоземельних елементів, карбонатів.
