Газові закони
2-й семестр
МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА
1. Властивості газів, рідин, твердих тіл
Урок 4/75
Тема. Газові закони
Мета уроку: встановити залежність між двома макропараметрами газу за незмінного третього
Тип уроку: вивчення нового матеріалу
План уроку
Демонстрації | 5 хв. | 1. Залежність тиску від об’єму за постійної температури. 2. Залежність об’єму газу від температури за постійного тиску. 3. Залежність тиску газу від температури при постійному |
Вивчення нового матеріалу | 30 хв. | 1. Абсолютна шкала температур. 2. Модель ідеального газу. 3. Ізопроцеси. 4. Ізобарний процес. 5. Ізохорний процес. 6. Ізотермічний процес |
Закріплення вивченого матеріалу | 10 хв. | 1. Тренуємось розв’язувати задачі. 2. Контрольні запитання |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Абсолютна шкала температур
Спосіб визначення температури не пов’язаний з властивостями однієї конкретної речовини. Для визначення температури можна запропонувати застосування властивостей газів,
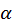 T), де р і р0 – відповідно тиск газу за температури t °С і 0 °С, а
T), де р і р0 – відповідно тиск газу за температури t °С і 0 °С, а 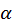 = 1/273 – термічний коефіцієнт тиску.
= 1/273 – термічний коефіцієнт тиску.З’єднавши посудини, у яких знаходиться газ, з манометром, можна виміряти температуру за показаннями манометра. При цьому слід звернути увагу на дивний факт: за температури t = -273 °С тиск газу має дорівнювати нулю. Природно брати цю температуру за точку відліку нової температурної шкали, залишивши в якості другої точки відліку температуру танення льоду за нормальних умов.
Якщо за температури нуль термометрична величина перетворюється на нуль, то така пікала називається абсолютною шкалою, а температура, яка рахувалася за такою шкалою, називається абсолютною температурою. Описану вище шкалу називають шкалою Кельвіна, а одиницю температури в цій шкалі – градусом Кельвіна (позначення: К).
Наприклад, абсолютному нулю температури (t = -273°С) відповідає Т = 0 К, а температурі танення льоду (t = 0°С) відповідає T = 273 К. Співвідношення між T I t виражається формулою:
Т= t + 273.
2. Модель ідеального газу
Звичайно, в основі побудови будь-якої теорії лежить метод моделей, який полягає у тому, що замість реального фізичного об’єкта або явища розглядають його спрощену модель. У МКТ газів використовується модель ідеального газу.
З точки зору молекулярних уявлень, гази складаються з атомів або молекул, відстані між якими значно більші за їх розміри. Внаслідок цього сили взаємодії між молекулами газів практично відсутні. Взаємодія між ними фактично відбувається лише під час короткочасних зіткнень.
Оскільки взаємодія молекул ідеального газу зводиться лише до короткочасних зіткнень і розміри молекул не впливають на тиск і температуру газу, ми можемо вважати, що: ідеальний газ – набір невзаємодіючих матеріальних точок.
O Модель реального газу, у якій нехтують розмірами молекул газу й їх взаємодією між зіткненнями, називають ідеальним газом.
Розріджений газ з чіткою точністю можна вважати ідеальним газом.
3. Ізопроцеси
Стан даної маси газу визначається трьома макроскопічними параметрами – тиском р, об’ємом Vі температурою Т. Однак, багато процесів у газах, що відбуваються в природі, або які здійснюються в техніці, можна розглядати (наближено) як процеси, у яких змінюються лише два з них. Особливе значення у фізиці й техніці мають, так звані, ізопроцеси.
O Ізопроцесами називають процеси, що відбуваються з даною масою газу за постійного значення одного з трьох параметрів – тиску, об’єму або температури.
Ізопроцес – це ідеалізована модель реального процесу, яка тільки наближено відображає дійсність.
4. Ізобарний процес
O Зміна об’єму й температури газу за постійного тиску називається ізобарним процесом.
Під час ізобарного процесу об’єм газу прямо пропорційний його абсолютній температурі: V/T = const при р = const. Це співвідношення називають законом Гей-Люссака на честь французького вченого, який відкрив його на початку 19-го століття.
Закон Гей-Люссака дозволяє зв’язати значення об’єму і температури даної маси газу в двох різних станах, якщо тиск газу в обох станах однаковий. Позначимо V1 і Т1 значення об’єму та температури газу в стані 1, a V2 і Т2 – у стані 2. Тоді з співвідношення V/T = const, отримуємо 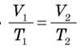 чи інакше:
чи інакше:
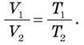
O Під час ізобарного процесу об’єм даної маси газу прямо прямо пропорційний його абсолютної температурі.
Співвідношення між об’ємом даної маси газу й абсолютною температурою за постійного тиску зображено графічно на рисунку.
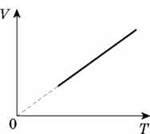
Цей графік називають ізобарою. Він показує, що при постійному тиску об’єм газу прямо пропорційний його абсолютній температурі.
5. Ізохорний процес
O Зміна тиску й температури газу з постійним об’ємом, називають ізохорним процесом.
Досвід показує: якщо нагрівати газ з постійним об’ємом, тиск газу буде збільшуватися прямо пропорційно до абсолютної температури. Це означає, що при ізохорному процесі тиск газу прямо пропорційний до його абсолютної температури:
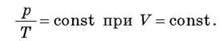
Залежність тиску газу від температури була досліджена в кінці 18-го століття французьким ученим Шарлем, тому таке співвідношення називають законом Шарля.
O При ізохорному процесі тиск даної маси газу прямо пропорційний до його абсолютної температури.
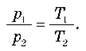
Графік залежності р(Т) при V = const називають ізохорою.
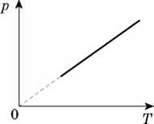
Цей графік показує, що з постійним об’ємом тиск газу прямо пропорційний до його абсолютної температури.
6. Ізотермічний процес
O Зміна тиску та об’єму газу за постійної температури називають ізотермічним процесом.
Досвід показує: якщо стискати газ за постійної температури, тиск зростає обернено пропорційно до об’єму. Це означає, що під час ізотермічного процесу тиск газу обернено пропорційний до його об’єму: pV = const при Т= const.
Це співвідношення було виявлено під час досліду в другій половині 17-го століття англійським ученим Бойлем і французьким ученим Маріоттом, тому його називають законом Бойля – Маріотта.
O Під час ізотермічного процесу тиск даної маси газу обернено пропорційний до його об’єму.
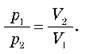
Графік залежності p(V) при Т = const називають ізотермою.
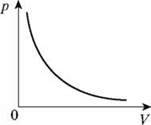
Цей графік показує, що за постійної температури тиск газу обернено пропорційний його об’єму.
Питання до учнів під час викладення нового матеріалу
1. Зобразіть графік ізобарного процесу в координатах (р, Т) і (P, V).
2. Зобразіть графік ізохорного процесу в координатах (V, T) і (P, V).
3. Зобразіть графік ізотермічного процесу в координатах (V, T) і (Р, Т).
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Тренуємось розв’язувати задачі
1. Дано два графіка одного й того ж ізопроцесу. Що це за процес? У яких осях він зображений?
2. Газ стиснутий ізотермічно від об’єму 8 л до об’єму 6 л. Тиск при цьому зріс на 4 кПа. Яким був початковий тиск?
3. За температури -23 ° С газ займає об’єм 60 л. Який буде об’єм газу за 127 ° С? Тиск газу не змінився.
2). Контрольні запитання
1. Як забезпечується ізобарність процесу в газі?
2. Як забезпечується ізохорність процесу в газі?
3. Як забезпечується ізотермічність процесу в газі?
4. Які межі застосовності газових законів?
Про що ми дізналися на уроці
– Якщо за температури нуль термометрична величина перетворюється на нуль, то така шкала називається абсолютною шкалою, а температура, яка рахувалася за такою шкалою, називається абсолютною температурою.
– Модель реального газу, у якій нехтують розмірами молекул газу та їх взаємодією між зіткненнями, називають ідеальним газом.
– Ізопроцесами називають процеси, що відбуваються з даною масою газу за постійного значення одного з трьох параметрів – тиску, об’єму або температури.
– Закон Гей-Люссака: дозволяє зв’язати значення об’єму й температури даної маси газу в двох різних станах, якщо тиск газу в обох станах однаковий:
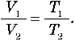
– Закон Шарля: під час ізохорного процесу тиск даної маси газу прямо пропорційний його абсолютній температурі:
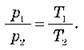
– Закон Бойля – Маріотта: під час ізотермічного процесу тиск даної маси газу обернено пропорційний його об’єму:
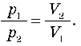
Домашнє завдання
1. Конспект.
2. Розв’яжіть задачі:
Р1): 1. Якщо надувати дитячу гумову кульку повітрям, то об’єм її збільшується, однак тиск повітря в кульці теж збільшується. Чи не суперечить це закону Бойля-Маріотта?
2. Чому плавальний міхур у риб, що були спіймані в глибоких водоймах, виходить через рот назовні, коли їх витягують з води?
3. Назвіть температуру танення льоду й кипіння води з нормальним тиском у градусах Цельсія й у кельвінах.
4. За температури 294 К об’єм газу дорівнює 0,35 дм3. За якої температури об’єм тієї ж маси газу збільшиться до 0,4 дм3? Тиск газу вважайте постійним.
Р2): 1. Тиск газу в балоні за 27 °С дорівнює 240 кПа. Яким стане тиск після нагріву газу до 100 °С?
2. На скільки градусів треба ізобарно нагріти газ, щоб він набув об’єму, удвічі більшого у порівнянні з об’ємом за 0 °С?
3. Об’єм газу в результаті ізобарного процесу зменшився на 10 л, а абсолютна температура знизилася в 1,2 рази. Визначте початковий об’єм газу.
4. Після збільшення абсолютної температури в 1,2 рази, об’єм газу збільшився на 0,6 л з постійним тиском. Знайдіть первинний об’єм газу.
Р3): 1. При ізотермічному стисненні об’єм газу зменшився на 5 л, а тиск збільшився в 3 рази. Яким був початковий об’єм газу?
2. Тиск деякої маси ідеального газу збільшили ізотермічно вдвічі. Як при цьому змінилася густина газу?
3. Під час ізобарного нагрівання абсолютну температуру ідеального газу збільшили вдвічі. У скільки разів змінилася густина газу?
4. Об’єм бульбашки повітря в період спливання її з дна озера на поверхню вади збільшується в три рази. Яка глибина озера? Зміною температури з глибиною можна знехтувати.
