Гідроген пероксид – Гідроген
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.1. Гідроген
9.1.4. Гідроген пероксид
Склад та будова молекули
Формула гідроген пероксиду – Н2О2.
Це ковалентна дуже полярна молекула:
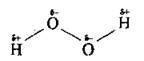
З водою змішується в будь-яких співвідношеннях. Розчин з масовою часткою Н2О2 30% називають пергідролем. Концентровані розчини гідроген пероксиду на повітрі вибухають.
Це нестійка (у розчинах) речовина,
Поширеність гідроген пероксиду в природі
Гідроген пероксид утворюється при окисненні багатьох речовин киснем повітря, його сліди є в атмосферних опадах. Утворюється в живих організмах (тваринних та рослинних), але концентрації його дуже малі – під впливом ферментів він розкладається (з виділенням атомарного Оксигену) і окислює органічні речовини.
Добування гідроген
Гідроген пероксид можна витісняти з пероксидів сильнішими кислотами, зокрема навіть карбонатною:
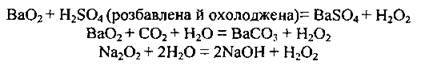
Хімічні властивості гідроген пероксиду
1. Гідроген пероксид у реакціях може виявляти як окислювальні (більш характерні, а), так і слабкі відновлювальні властивості (б):
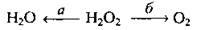
Наприклад:
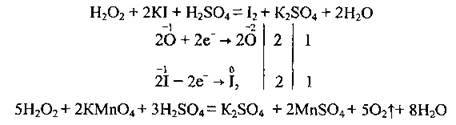
2. При тривалому зберіганні Н2О2 повільно розкладається
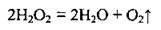
Реакція пришвидшується наявністю слідів металів Cu, Mn, Fe, Pt та їхніх катіонів, МnO2, вуглецю, електричним розрядом. Ця реакція належить до реакцій диспропорціонування (самоокиснення – самовідновлення), тому що атоми Оксигену змінюють проміжний ступінь окиснення -1 (у молекулі Н2O2) на -2 (Н2O) і 0 (O2).
3. Гідроген пероксид реагує з деякими основами:
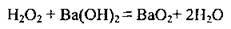
Застосування гідроген пероксиду
Гідроген пероксид використовують:
– для первинної обробки ран у медицині як антисептик і кровоспинний засіб (під впливом ферменту каталази Н2O2 розкладається з виділенням атомарного Оксигену) у вигляді розчину з масовою часткою Н2O2 3%;
– для дезінфекції в харчовій промисловості;
– як м’який відбілювач для паперу, пір’я, пуху, волосся, рогу;
– для виробництва відбілювачів, які вводять у синтетичні мийні засоби; як піноутворювач у виробництві деяких пластмас;
– для реставрації картин, написаних свинцевими фарбами;
– в органічному синтезі (добування метанолу та інших речовин);
– як окислювач у ракетному паливі.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Гідроген пероксид – ОКСИГЕН. СУЛЬФУР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ОКСИГЕН. СУЛЬФУР Гідроген пероксид Фізичні властивості гідроген пероксиду Між молекулами Н2О2 виникають міцні водневі зв’язки, унаслідок чого речовина являє собою в’язку, важку (ρ = 1,44 г/см3) рідину блідо-голубого кольору з високою температурою кипіння (Тпл = +0,4 °С, Ткип = +150 °С). […]...
- ГІДРОГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ – ВОДЕНЬ Хімія – універсальний довідник ВОДЕНЬ ГІДРОГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ У сполуках Гідроген одновалентний (його валентність прийнята за 1). Він утворює сполуки з переважною більшістю хімічних елементів (крім інертних газів і деяких металів В груп). У сполуках з Гідрогеном усі неметали проявляють свою нижчу валентність. Сполуки Гідрогену з металами називаються гідридами. Наприклад, NаН – гідрид натрію, […]...
- ДОБУВАННЯ КИСНЮ З ГІДРОГЕН ПЕРОКСИДУ, ЗБИРАННЯ, ДОВЕДЕННЯ ЙОГО НАЯВНОСТІ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ПРАКТИЧНА РОБОТА № 4 Тема. Добування та збирання кисню. Мета роботи: освоїти одержання кисню лабораторним способом та навчитись виявляти його наявність. Речовини та обладнання: гідроген пероксид, пробірки, штатив для пробірок, пробка з газовідвідною трубкою, лабораторний штатив, напівзаповнений водою хімічний стакан чи плоскодонна колба, скляна чи виготовлена з іншого матеріалу, пластинка […]...
- Водень – Гідроген ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали Атоми неметалічних елементів мають у зовнішньому енергетичному рівні (окрім енергетичних елементів) значну кількість електронів (від чотирьох до семи) і здатні приєднувати певну кількість електронів, а саме стільки, скільки їх не вистачає до октету. Розгляньмо електронну будову […]...
- Гідроген хлорид. Хлоридна кислота ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.2. Галогени 9.2.2. Гідроген хлорид. Хлоридна кислота Гідроген хлорид (хлороводень) Молекула хлороводню є ковалентною, лінійною, полярною, з одним a-зв’язком. Атом електронегативнішого Хлору зміщує у свій бік спільну електронну хмару: Кристалічні гратки твердого хлороводню молекулярні. Ступінь окиснення […]...
- Гідроген – ГІДРОГЕН. ВОДЕНЬ. ВОДА Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГІДРОГЕН. ВОДЕНЬ. ВОДА Гідроген Характеристика хімічного елемента Гідроген – 1-й елемент Періодичної системи (заряд ядра 1), хімічний знак – Н, відносна атомна маса 1,008 (округлено 1). Валентність Гідрогену у сполуках дорівнює одиниці, найпоширеніший ступінь окиснення +1. Молекула водню Н2, молекулярна маса […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Гідроген – ВОДЕНЬ. ГАЛОГЕНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.2. Гідроген Місце гідрогену в періодичній системі. Гідроген займає перше місце в періодичній системі (Z = 1). Він має найпростішу будову атома: ядро атома оточене електронною хмарою. Електронна конфігурація ls1. За одних умов гідроген виявляє металічні властивості […]...
- Сірководень (гідроген сульфід). Сірководнева (сульфідна) кислота. Сульфіди – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.7. Сірководень (гідроген сульфід). Сірководнева (сульфідна) кислота. Сульфіди2 Сірководень та сірководнева кислота Сірководень, або гідроген сульфід H2S,- летка сполука Сульфуру з Гідрогеном. У молекулі сірководню атом Сульфуру утворює два ковалентні полярні зв’язки […]...
- Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота I СЕМЕСТР Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.) УРОК 8 Тема уроку. Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота Цілі уроку: розширити знання про хімічні властивості неметалів на прикладі їхніх сполук із Гідрогеном, знання про властивості кислот на прикладі гідроген хлориду та хлоридної кислоти, властивості хлоридів; продовжити формування практичних умінь […]...
- Очищення води – Гідроген ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.1. Гідроген 9.1.3. Очищення води За даними 00Н сьогодні із 7 млрд. людей нашої планети більше 1,2 млрд. живуть в умовах постійного дефіциту прісної води, і ще близько 2 млрд. – страждають від нього регулярно. Отже, […]...
- Основні оксиди – Оксиди – Основні класи неорганічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 7. Основні класи неорганічних сполук 7.1. Оксиди Оксиди – це бінарні сполуки елементів з Оксигеном, у яких він виявляє ступінь окислення -2. Характерні Ознаки оксидів: – ступінь окиснення Оксигену – -2; – атоми Оксигену не зв’язані між собою, а сполучаються лише з атомами […]...
- Тема 23. Оксиген Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ НЕОРГАНІЧНА ХІМІЯ Тема 23. Оксиген Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Виберіть властивості, що характерні для гідроген пероксиду: A. Окисні; Б. Відновні; B. Окисні і відновні; Г. Основні. 2. Укажіть вміст кисню в атмосфері Землі: A. 80 %; […]...
- Загальна характеристика – Урок 3 – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.1. Загальна характеристика До складу головної підгрупи VI групи1 належать Оксиген, Сульфур, Селен, Телур і Полоній. Елементи цієї підгрупи ще називають халькогенами2, або елементами підгрупи Оксигену. Це p-елементи; будова зовнішнього електронного рівня […]...
- Вода – Гідроген ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.1. Гідроген 9.1.2. Вода Світовий океан вкриває близько 71 % земної поверхні. Маса гідросфери – 1,39 · 1018 т – складає 0,05 % маси планети (але це удесятеро менше, ніж міститься у мантії Землі). Багато води […]...
- Оксиген. Кисень, його добування та фізичні властивості ТЕМА 2. ПРОСТІ РЕЧОВИНИ МЕТАЛИ І НЕМЕТАЛИ Урок 1. Оксиген. Кисень, його добування та фізичні властивості Цілі: вивчити характеристику кисню як простої речовини, його фізичні властивості, добування, способи збирання і виявлення; розкрити суть реакцій розкладу, суть поняття каталізатор. Обладнання: таблиці “Типи хімічних реакцій”, “Способи збирання газів”, штатив, пробірки, спиртівка, вата, пробка з газовідвідною трубкою, кристалізатор, […]...
- Вода – ГІДРОГЕН. ВОДЕНЬ. ВОДА Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГІДРОГЕН. ВОДЕНЬ. ВОДА Вода Мабуть, на Землі немає більш поширеної і водночас більш загадкової речовини, ніж вода в рідкій і твердій фазах. Дійсно, досить пригадати, що все живе вийшло з води і складається з неї більш ніж на 50 %, що […]...
- Оксиген – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.2. Оксиген Оксиген – 8-й елемент періодичної таблиці, заряд ядра – +8. Хімічний символ – О. Відомо три стабільні природні ізотопи Оксигену: 16O,17O, 18O, серед яких найчастіше трапляється 16О (99,76 %). Оксиген […]...
- Добування кисню. Реакція розкладу Тема 2 Кисень & 17. Добування кисню. Реакція розкладу Опанувавши цю тему, ви зможете: – знати реакції, які взято за основу добування кисню в лабораторії та промисловості, способи збирання кисню і реакції розкладу; – складати рівняння реакцій добування кисню; – формулювати визначення реакції розкладу, каталізатора і розуміти їхню суть; – досліджувати наявність кисню; – формувати […]...
- ВОДЕНЬ У ПРИРОДІ – ВОДЕНЬ Хімія – універсальний довідник ВОДЕНЬ ВОДЕНЬ У ПРИРОДІ За поширенням у Всесвіті Гідроген займає перше місце. На його частку припадає близько 92% всіх атомів (8% складають атоми Гелію, частка всіх інших разом узятих елементів – менше 0,1%). Таким чином, Гідроген – основна складова частина зірок і міжзоряного газу. В умовах зоряних температур (наприклад, температура поверхні […]...
- Проста речовина кисень. Фізичні властивості кисню. Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори Тема 2 ПРОСТІ РЕЧОВИНИ МЕТАЛИ Й НЕМЕТАЛИ Урок 26 Тема. Проста речовина кисень. Фізичні властивості кисню. Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори Цілі: поглибити знання учнів про просту речовину кисень, його фізичні властивості; сформувати уявлення про реакції розкладу та каталізатори на прикладі реакцій одержання кисню в лабораторії; підготувати учнів до практичній роботі […]...
- Виявлення Гідрогену й Оксисену – Якісний аналіз – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК Виявлення Гідрогену й Оксисену Майже всі органічні сполуки містять Гідроген. Цей Гідроген окислюється при спалюванні або при нагріванні в присутності купрум(ІІ) оксиду, утворюючи воду, яка легко виявляється за допомогою смужки паперу, просоченого кобальт хлоридом: При цьому колір змінюється з синього на рожевий. При піролізі (термічному розщеплюванні без доступу повітря) органічної сполуки утворення […]...
- Добування і зберігання кисню Контрольні запитання № 1. Реакції відбуваються при дуже високих температурах, тому їх використовувати для добування кисню в лабораторії не дуже зручно. № 2. Відповідь: а) калій перманганат КМnO4; в) вода Н2O; № 3. Реакції, внаслідок яких з однієї складної речовини утворюється дві чи більше нових речовин, називають реакціями розкладу. Приклади: 2КСlO3 = 2КСl + 3O2 […]...
- КИСЕНЬ У ПРИРОДІ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ КИСЕНЬ У ПРИРОДІ Оксиген – найпоширеніший хімічний елемент на Землі. Повітря, що нас оточує, містить кисню 23% за масою і 21% за об’ємом. Ще більше Оксигену знаходиться у зв’язаному стані в земній корі – 47% за масою і 92% за об’ємом. У гідросфері – водах океанів, морів і т. д. […]...
- Важка вода – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.4. Важка вода Вода, що містить важкий гідроген, називається важкою водою (позначається формулою D2O). Як бачимо із зістав лення фізичних властивостей, вона відрізняється від звичайної води: D2O Н2O Молекулярна маса 20 18 Густина при 20°С, г/cм? 1,1050 […]...
- Ступінь окиснення ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.9. Ступінь окиснення Для запису окисно-відновних реакцій користуються поняттям ступеня окиснення. Ступінь окиснення – це умовна величина заряду атома елемента, яка визначається з припущення, що речовина має йонний тип хімічного зв’язку, тобто спільна електронна пара повністю належить атому більш електронегативного […]...
- Відносна атомна маса. Відносна молекулярна маса Контрольні запитання № 1. Відносна атомна маса – це відношення маси атома даного елемента до 1/12 маси атома Карбону. Відносна молекулярна маса М показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону. Для речовин йонної будови хімічна формула відображає склад формульної одиниці. Тому для таких речовин використовують відносну формульну масу. № 2. […]...
- ОКИСНІ ВЛАСТИВОСТІ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ ОКИСНІ ВЛАСТИВОСТІ ГАЛОГЕНІВ Кожен галоген, що стоїть у періодичній системі вище, являючись сильнішим окисником, ніж той, що стоїть нижче, витискає його зі сполук з металами. Наприклад: Висока окисна активність галогенів виявляється в їх високій хімічній, а тому і біологічній активності. Навіть найслабший серед них окисник, Йод, має антисептичну дію – […]...
- Фізичні властивості алкенів – АЛКЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛКЕНИ Фізичні властивості алкенів Фізичні властивості алкенів схожі на властивості алканів, хоча вони мають трохи нижчі температури плавлення й кипіння, ніж відповідні алкани. Наприклад, пентан має температуру кипіння +36 °С, а пентен-1 – +30 °С. За звичайних умов алкени С2 – […]...
- Вплив середовища на характер перебігу реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.4. Вплив середовища на характер перебігу реакцій Реакції окиснення – відновлення можуть відбуватися в різних середовищах: у кислому (надлишок Н+-іонів), нейтральному (Н2О) і лужному (надлишок гідроксид-іонів ОН – ). Залежно від середовища може змінюватись і характер […]...
- Приклади розв’язування типових задач – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Укажіть кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду. Розв’язання Сl2O. Будова електронних оболонок елементів Хлору і Оксигену: З формули видно, що Хлор перебуває в основному (незбудженому) стані та виявляє валентність І. […]...
- Валентність Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Валентність При утворенні молекули атоми не просто об’єднуються в якийсь безладний клубок, а зв’язуються в певній послідовності особливими хімічними зв’язками. Причому кожен атом може утворити не нескінченне, а тільки певне число таких зв’язків. У XIX столітті вчені встановили, […]...
- Будова молекули води. Водневий зв’язок між молекулами води ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.4. Будова молекули води. Водневий зв’язок між молекулами води У молекулі води є два ковалентні полярні зв’язки між атомом Оксигену і двома атомами Гідрогену. Через велику різницю електронегативності Оксигену (3,5) і Гідрогену (2,2) електронні хмари зміщені в бік Оксигену, […]...
- Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач Суть розв’язування задач цього типу полягає в розстановці коефіцієнтів і перетворенні схем реакцій на рівняння. Задача 1. Схема реакції: Ставимо коефіцієнт 4 перед формулами NH3 і NO, а коефіцієнт 5 – перед формулою O2: Залишається дібрати […]...
- Хімічні властивості алкенів – АЛКЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛКЕНИ Хімічні властивості алкенів Хімічні властивості алкенів визначаються наявністю в їхній молекулі подвійного зв’язку. При приєднанні полярних молекул типу НХ (X; Hаl, ОН, СN до несиметричних алкенів Гідроген переважно приєднується до більш гідрогенізованого атома Карбону, що примикає до подвійного зв’язку (правило […]...
- ДОБУВАННЯ КИСНЮ З ГІДРОГЕНПЕРОКСИДУ, ЗБИРАННЯ, ДОВЕДЕННЯ ЙОГО НАЯВНОСТІ Тема 2 КИСЕНЬ & 26. ДОБУВАННЯ КИСНЮ З ГІДРОГЕНПЕРОКСИДУ, ЗБИРАННЯ, ДОВЕДЕННЯ ЙОГО НАЯВНОСТІ Вивчення параграфа допоможе вам: · закріпити знання про реакцію розкладу, каталізатор, способи збирання газів; · збирати прилад для добування кисню; · визначати наявність кисню дослідним шляхом; · повторити і застосувати правила безпеки під час роботи в кабінеті хімії Виконуючи цю практичну роботу, […]...
- Фізичні властивості алкінів – АЛКІНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛКІНИ Фізичні властивості алкінів Фізичні властивості алкінів схожі на властивості алканів та алкенів. При звичайних умовах (С2-С4) – гази, (С5-С16) – рідини, починаючи із С17 – тверді речовини. Температури кипіння алкінів вищі, ніж у відповідних алкенів. Так, етилен має температуру кипіння […]...
- Взаємодія деяких оксигено – та нітрогеновмісних сполук з реагентами ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 11. Взаємодія деяких оксигено – та нітрогеновмісних сполук з реагентами Реагент Бромна вода Луги (КОН, NaOH) Карбонати, Гідроген-карбонати Активні метали (К, Mg, Аl) Купрум(ІІ) гідроксид Ag2O(NH3) Спирти – – – + – – Фенол Білий осад + – + – – Багатоатомні спирти – + […]...
- Поняття про вуглеводи та їхня класифікація – ВУГЛЕВОДИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ ВУГЛЕВОДИ Поняття про вуглеводи та їхня класифікація Загальна формула вуглеводів: Сn(Н2O)m, однак це не означає, що вуглеводи складаються з вугілля та окремих молекул води. Ця формула відображає лише співвідношення атомів Карбону, Гідрогену та Оксигену в молекулах вуглеводів. І, власне, саме такому […]...
- Фізичні властивості альдегідів – АЛЬДЕГІДИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛЬДЕГІДИ Фізичні властивості альдегідів Альдегіди – безбарвні речовини, з характерним запахом. Перший член гомологічного ряду альдегідів – формальдегід – при звичайних умовах є газоподібною речовиною (на відміну від спиртів). Формула Назва ІUРАС Tпл, °C Tкип, °C Розчинність уводі НСНО Метаналь -92 […]...