Карбон та його властивості – ПІДГРУПА КАРБОНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 11. ПІДГРУПА КАРБОНУ
§ 11.2. Карбон та його властивості
Поширення в природі. В природі карбон трапляється у вільному стані у вигляді алмазу, графіту і Карбіну, в сполуках
– у вигляді кам’яного і бурого вугілля та нафти. Входить до складу природних карбонатів: вапняку, мармуру, крейди СаСО3, магнезиту МgСО3, доломіту МgСО3 ∙ СаСО3. Є головною складовою частиною органічних речовин. Вміст карбону в земній корі – 0,1 %. У повітрі міститься
Фізичні властивості. Алотропічні модифікації вуглецю – (алмаз, графіт та карбін – мають різко відмінні фізичні властивості, що пояснюється будовою їх кристалічних решіток.
Алмаз – безбарвна кристалічна речовина з атомною решіткою. Атоми карбону в кристалах алмазу перебувають у стані 5р3-гібридизації (див. § 3.2). Вони зв’язані міцними ковалентними неполярними зв’язками. Кожен атом карбону в алмазі оточений чотирма іншими, розташованими від нього в напрямах від центра тетраедра до його вершин (чотири σ- зв’язки, рис. 11.1). Все це зумовлює виняткову твердість, значну густину
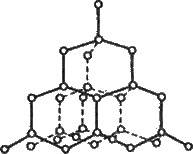
Рис. 11.1. Кристалічна решітка алмазу
Його широко застосовують для різання скла, буріння гірських порід і шліфування особливо твердих матеріалів. Алмаз погано проводить теплоту і практично не проводить електричного струму. Зразки його в чистому вигляді сильно заломлюють світло (світяться). Тому з алмазів виготовляють прикраси (діаманти).
Великі родовища алмазів відкрито в Якутії. Крім того, з 1961 р. налагоджено їх промислове виробництво з графіту.
Графіт – темно-сіра кристалічна речовина зі слабким металічним блиском, масна на дотик. Атоми карбону в кристалах графіту перебувають у стані sp – гібридизації (див. § 3.2). Вони об’єднані в плоскі шари, що складаються з правильних шестикутників (рис. 11.2). У них кожен атом карбону сполучений міцними ковалентними зв’язками з трьома сусідніми атомами (три σ-зв’язки). Зв’язки напрямлені один до одного під кутом 120°. Четвертий валентний електрон кожного атома в шарі залишається рухливим, як у металі, і може переміщуватися від одного атома карбону до іншого. За рахунок таких електронів виникає металічний зв’язок. Цим пояснюється висока електрична провідність графіту (але гірша, ніж у металів), a також його теплопровідність та металічний блиск.
Відстань між шарами в графіті досить велика (0,335 нм), а сили взаємодії між ними порівняно слабкі (це в основному міжмолекулярні сили). Тому графіт розщеплюється на тонкі лусочки, які самі по собі дуже міцні. Лусочки легко прилипають до паперу.
Графіт застосовують для виробництва грифелів олівців, а також електродів (у промисловому електролізі). В суміші з технічними маслами використовується як мастило: його лусочки усувають нерівності поверхні, яку змащують. Оскільки він тугоплавкий і добре витримує різку зміну температур, із суміші графіту і глини виготовляють плавильні тиглі для металургії. Використовують графіт і в ядерних реакторах як уповільнювач нейтронів.
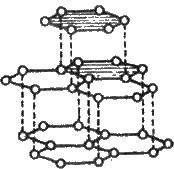
Рис. 11.2. Кристалічна решітка графіту
Трапляється графіт у вигляді великих покладів у Сибіру, на Алтаї та в інших місцях. Налагоджено також виробництво графіту штучним способом з коксу.
Карбін – дрібнокристалічний порошок чорного кольору. Вперше синтезований у 60-х роках російськими хіміками, пізніше був знайдений у природі. Кристали карбіну складаються з лінійних ланцюжків атомів карбону, сполучених одинарними і потрійними зв’язками, що чергуються:
… – С≡С-С≡С-С≡С – … або (-С≡С-)n.
За твердістю карбін перевершує графіт, але значно поступається перед алмазом. Має напівпровідникові властивості. Під час нагрівання до 2 800 °С без доступу повітря перетворюється на графіт.
Природний карбон як елемент складається з двох ізотопів: 106°С (98,892 %) та 136С (1,108 %). Крім того, в атмосфері виявлено незначні домішки радіоактивного ізотопу 614С, який добувають штучним способом і широко застосовують у наукових дослідженнях.
Вугілля. При термічному розкладанні карбонових сполук утворюється чорна маса – вугілля і виділяються леткі продукти. Вугілля являє собою тонкоподрібнений графіт. Найважливішими сортами вугілля є кокс, деревне вугілля і сажа.
Кокс добувають нагріванням кам’яного вугілля без доступу повітря. Застосовується в металургії як відновник.
Деревне вугілля утворюється під час обвуглювання деревини (нагрівання без доступу або при незначному доступі повітря). Застосовується в металургійній промисловості, у ковальських горнах, для добування чорного пороху, поглинання газів, а також у побуті.
Сажа утворюється з вуглеводнів (природного газу, ацетилену, скипидару тощо) спалюванням їх при обмеженому доступі повітря (або термічним розкладом без доступу повітря). Застосовується як наповнювач у виробництві гуми, а також для виготовлення чорних фарб (друкарська фарба, туш) та вакси для взуття. Скловуглець – приклад існування вуглецю в аморфній формі. Він також утворюється при термічному розкладанні вуглецевих сполук. Має унікальні властивості: велику механічну міцність, малу густину, електричну провідність, тугоплавкість та стійкість проти агресивних середовищ. Тому застосовується для виготовлення апаратури для сильноагресивних середовищ, а також в авіації та космонавтиці.
Адсорбція. Вугілля (особливо деревне) має велику адсорбційну здатність.
Адсорбцією називається властивість вугілля та інших твердих або рідких речовин утримувати на своїй поверхні пари, гази і розчинені речовини.
Речовини, на поверхні яких відбувається адсорбція, називаються адсорбентами. Речовини, що адсорбуються, називають адсорбатами. Якщо, наприклад, розчин чорнила збовтати з дрібно розтертим вугіллям, а потім суміш профільтрувати, то у фільтраті буде безбарвна рідина – вода. У цьому випадку вся розчинена фарба адсорбується вугіллям. Вугілля – адсорбент, фарба – адсорбат.
У техніці як адсорбенти застосовують алюмосилікати, синтетичні смоли та інші речовини.
Адсорбційна здатність вугілля зумовлюється його поруватістю. Чим більше пор, тим більша поверхня вугілля і тим більша адсорбційна здатність. Звичайно пори деревного вугілля частково заповнені різними речовинами, що знижує його адсорбційну здатність. Для підсилення адсорбції вугілля спеціально обробляють – нагрівають у струмені водяної пари, щоб звільнити його пори від забруднюючих речовин. Оброблене таким способом вугілля називають активним.
Активне вугілля широко застосовується для очищення цукрового сиропу від домішок, які надають йому жовтого кольору, для очищення рослинних олій та жирів. У медицині таблетки з активного вугілля (“карболен”) використовують для видалення шкідливих речовин з організму. Активне вугілля застосовується у протигазах для поглинання отруйних речовин. Фільтруючий протигаз, створений М. Д. Зелінським, застосовувався у світову війну 1914-1918 pp., що дало змогу врятувати життя багатьом десяткам тисяч людей.
Хімічні властивості. За звичайної температури вугілля досить інертне. Його хімічна активність виявляється лише при високих температурах. Як окисник, вугілля реагує з деякими металами і неметалами. Сполуки карбону з металами називаються карбідами. Наприклад:
4Аl + ЗС = Аl4С3.
Карбід
Алюмінію
Велике практичне значення має карбід кальцію, який добувають нагріванням вапна СаО і коксу в електропечах:
СаО + ЗС = СаС2 + СО.
Карбід
Кальцію
3 воднем вугілля за наявності нікелевого каталізатора і при нагріванні утворює метан – основну складову частину природних горючих газів:
С + 2Н2 = СН4.
Однак для вугілля більш характерні реакції, в яких він виявляє відновні властивості. Це має місце при повному згорянні карбону будь-якої алотропічної модифікації:
С + O2 = СO2.
Вугілля відновлює залізо, мідь, цинк, свинець та інші метали з їх оксидів, що широко використовується в металургії під час добування цих металів. Наприклад:
2ZnO + С = 2Zn + СО2.
Дуже важлива хімічна властивість карбону – здатність його атомів утворювати міцні зв’язки між собою – вуглецеві ланцюги (див. ч. III. Органічна хімія).
