Кількість речовини. Моль
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 3
Тема. Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро
Цілі уроку: сформувати уявлення учнів про хімічне поняття “кількість речовини”; показати сутність фізичної величини кількості речовини; ознайомити з одиницею вимірювання кількості речовини; увести поняття “моль”, “стала Авогадро”.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, бесіда.
Обладнання: Періодична система хімічних елементів
ХІД УРОКУ
І. Організація класу
II. Актуалізація опорних знань
Фронтальна бесіда
1) Із чого складаються всі речовини на Землі? (З атомів, молекул, іонів)
2) Наведіть приклади речовин молекулярної та немолекулярної будови. (І2, Cl2; NaCl, CaF2, алмаз)
3) В яких одиницях вимірюються розміри атомів? (нм, тобто 10-9 м, rа = 10-14 см, якщо атом збільшити до розміру друкарської крапки, то пропорційно збільшена людина досягала б зросту близько 7 км)
4) Якою є маса атома? (Це маленька частинка, реальна маса якої оцінюється величиною порядку 10-27 -10-26 кг)
5) Скільки молекул води Н2O міститься в краплі
6) А скільки атомів Карбону міститься в діаманті вагою 1 карат?
Розв’язати задачу нам допоможе величина, з якою ми познайомимося на сьогоднішньому уроці.
III. Вивчення нового матеріалу
Ще у XVIII столітті для хімічних обчислень водночас із масою й об’ємом було введено фізичну величину, яка дозволяла розрахувати кількість структурних частинок (атомів, молекул, іонів) у певній порції речовини. Ця величина одержала назву “кількість речовини”.
Кількість речовини – це фізична величина, що показує число структурних частинок (атомів, молекул, іонів) у певній порції цієї речовини. Позначається грецькою літерою  (ню). Одиниця вимірювання кількості речовини – моль.
(ню). Одиниця вимірювання кількості речовини – моль.
Відомий італійський учений Амедео Авогадро вивчив і виміряв кількість речовини для різних речовин. З допомогою спеціальних розрахунків А. Авогадро підрахував, що у 12 г вуглецю міститься 6,02 – 1023 атомів. Таку кількість речовини взяли за 1 моль.
Подібні розрахунки показали, що:
У 32 г сірки міститься 6,02 – 1023 атомів;
У 18 г води міститься 6,02 – 1023 молекул.
Ця величина одержала назву “стала Авогадро”. Позначається вона Na = 6,02 – 1023 частинок/моль, або моль-1. Ця величина не залежить від агрегатного стану речовини.
Отже, 1 моль – це кількість речовини, що містить стільки ж частинок (атомів, молекул, іонів), скільки атомів міститься у 12 г вуглецю, тобто 6,02 – 1023 частинок.
V = N/Na,
Де N – число частинок у порції речовини;
Na – стала Авогадро.
IV. Закріплення нового матеріалу (керована практика)
1. Обчисліть кількість речовини в порції води, що містить 12,04 – 1023 молекул.
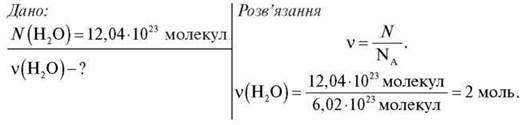
Відповідь: 2 моль.
2. Обчисліть число атомів Феруму в порції заліза кількістю речовини 5 моль.
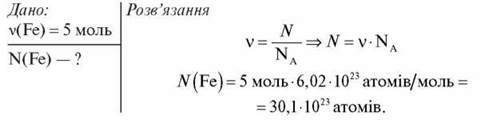
Відповідь: 30,01 – 1023 атомів.
V. Підбиття підсумків
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання.
Творче завдання. Обчислити кількість атомів Карбону в діаманті масою 1 карат (1 карат = 0,2 г).
