Кількість речовини. Постійна Авогадро
2-й семестр
МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА
1. Властивості газів, рідин, твердих тіл
Урок 2/73
Тема. Кількість речовини. Постійна Авогадро
Мета уроку: ознайомити учнів з поняттям: “кількість речовини, одиниця кількості речовини, постійна Авогадро”
Тип уроку: вивчення нового матеріалу
План уроку
Контроль знань | 5 хв. | 1. Основні положення МКТ та їх досліджені підтвердження. 2. Що таке макроскопічні й мікроскопічні параметри? Наведіть приклади. 3. |
Вивчення нового матеріалу | 30 хв. | 1. Кількість речовини. 2. Відносна молекулярна маса. 3. Постійна Авогадро. 4. Молярна маса |
Закріплення вивченого матеріалу | 10 хв. | 1. Тренуємося розв’язувати задачі. 2. Контрольні запитання |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Кількість речовини
У минулому столітті італійський вчений Авогадро виявив дивний факт: якщо два різних гази знаходяться в посудинах з однаковим об’ємом, однаковою температурою й тиском, то в кожній посудині знаходиться одне
O Фізична величина, яка визначає число молекул у даному тілі, називається кількістю речовини й позначається літерою V.
Так як маси окремих молекул відрізняються одна від одної, то однакові кількості різних речовин мають різну масу. Наприклад, 1025 молекул водню й 1025 молекул кисню вважаються однаковою кількістю речовини, хоча мають різні маси (33,45 г і 531,45 г відповідно). Таким чином, маса не є мірою кількості речовини. Одиницею кількості речовини є моль:
O один моль – це кількість речовини, яка містить стільки ж молекул, скільки атомів вуглецю міститься в 12 г вуглецю.
Для більшості розрахунків (у тому числі під час вирішення завдань) можна прийняти, що один моль містить стільки ж молекул, скільки атомів водню міститься в 1 г водню.
2. Відносна молекулярна маса
Маси окремих молекул дуже малі. Наприклад, маса однієї молекули води близько 3-10-26 кг. Молекули інших речовин мають маси такого ж порядку. Так як маси молекул дуже малі, зручно використовувати в розрахунках не абсолютні значення мас, а відносні. За міжнародними стандартами маси всіх атомів і молекул порівнюють з 1/12 маси атома вуглецю. Головна причина такого вибору полягає в тому, що вуглець входить у велике число різних хімічних сполук. Однак для більшості розрахунків (у тому числі під час розв’язання задач) можна прийняти, що одна атомна одиниця маси (1 а. о. м.) дорівнює масі атома водню.
O Масу молекули, виражену в атомних одиницях маси, називають відносною молекулярною масою. Відносна молекулярна маса позначається Мr.
Відносна молекулярна маса Мr дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома вуглецю mос:
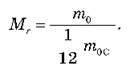
Аналогічно до відносної молекулярної маси визначається й відносна атомна маса, як маса атома, виражена в атомних одиницях маси. Значення відносної атомної маси для даної речовини можна знайти за допомогою таблиці Менделєєва, округливши наведене в ній значення до цілого.
Наприклад, відносні атомні маси гелію, вуглецю й кисню рівні відповідно 4, 12 і 16. Щоб визначити відносну молекулярну масу речовини, необхідно знати його хімічну формулу й відносні атомні маси атомів, що входять до складу молекули даної речовини.
Наприклад, відносна молекулярна маса води дорівнює 18, тому що відповідно до хімічної формули води (Н2O), молекула води складається з двох атомів водню (з відносною атомною масою 1) і одного атома кисню (з відносною атомною масою 16).
3. Постійна Авогадро
Число N молекул, що містяться в тілі, пропорційне кількості речовини v, що містяться в цьому тілі: N ~ v. Коефіцієнт пропорційності називають постійної Авогадро й позначають NA.
O Кількість молекул в одному молі називається постійною Авогадро: NA = 6,02-1023 1/моль.
Маса одного моля води, що містить NA молекул, дорівнює 18 г, а маса однієї молекули води дорівнює 18 а. о. м. Таким чином, постійна Авогадро є переказним множником між грамом і атомною одиницею маси: в одному грамі міститься NA атомних одиниць маси.
Так як постійна Авогадро чисельно дорівнює числу молекул в одному молі, то
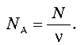
Якщо кількість речовини в даному тілі відома, то легко знайти число молекул N у цьому тілі:
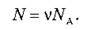
4. Молярна маса
O Масу одного моля речовини називають молярної масою.
Маса m тіла пропорційна кількості речовини v, що міститься в даному тілі. Тому відношення m/v характеризує речовину, з якої складається це тіло: чим “важчі” молекули речовини, тим більше це відношення.
O Відношення маси речовини т до кількості речовини v називається молярною масою і позначається М:
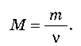
Якщо взяти в цій формулі v = 1, отримаємо, що молярна маса речовини чисельно дорівнює масі одного моля цієї речовини.
Одиницею виміру молярної маси в СІ є кг/моль, оскільки маса вимірюється в кілограмах, а кількість речовини – у молях. Наприклад, молярна маса водню дорівнює М = 2 г/моль = 2-10-3 кг/моль.
Якщо молярна маса М і кількість речовини відомі, можна знайти масу речовини: m = v – M.
Знання постійної Авогадро дозволяє знайти масу однієї молекули. Дійсно, нехай дане тіло містить 1 моль речовини. Тоді маса тіла чисельно дорівнює М, а число молекул у ньому чисельно дорівнює Na. Позначаючи масу однієї молекули m0, отримуємо
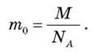
Можна сказати, що NA – це “місток” між макросвітом (світом оточуючих нас тіл) і мікросвітом (світом атомів і молекул). Якщо дане тіло містить v молей речовини, то число молекул N у цьому тілі визначається виразом:
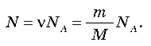
Відношення числа молекул N до об’єму V, займаному цими молекулами, називається концентрацією молекул і позначається n:
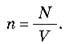
Концентрація молекул вимірюється в 1/м3.
Питання до учнів під час викладення нового матеріалу
1. Чому молекулярна фізика використовує відносні величини для вимірювання маси?
2. Виразіть у кг / моль молярну масу водню, кисню й вуглекислого газу.
3. Яка відносна атомна маса атома водню? відносна молекулярна маса молекули водню? молекули води? молекули вуглекислого газу?
4. Як можна обчислити масу молекули будь-якої речовини?
5. Як знайти число молей речовини в тілі, якщо відома його маса?
6. Як знайти число молей речовини в тілі, якщо відомо число частинок у ньому?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Тренуємося розв’язувати задачі
1. Скільки молей міститься в 10 г кисню?
2. Яка маса 2 молей води?
3. Яка маса молекули вуглекислого газу?
4. Який об’єм займають 2 моля алюмінію?
Розв’язок
Об’єм алюмінію можна виразити через його масу та густину: V = m/?. Масу ж алюмінію можна виразити через кількість речовини і молярну масу: m = v – M. Звідси отримуємо 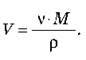 Відповідь: 20 см3.
Відповідь: 20 см3.
5. Маса якої молекули більша – аміаку (NH3) чи азотної кислоти (HNO3)?
2). Контрольні запитання
1. У чому вимірюють кількість речовини?
2. Скільки молекул в одному молі?
3. Як дізнатися відносну молекулярну масу речовини?
4. Як пов’язані маса молекули, молярна маса й постійна Авогадро?
5. Як визначити кількість молекул у даному тілі, якщо відомі маса тіла й молярна маса речовини?
Що ми дізналися на уроці
– Фізична величина, яка визначає число молекул у даному тілі, називається кількістю речовини й позначається літерою v.
– Один моль – це кількість речовини, яка містить стільки ж молекул, скільки атомів вуглецю міститься в 12 г вуглецю.
– Відносна молекулярна маса Мг дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома вуглецю mос:

– Кількість молекул в одному молі називається постійною Авогадро: NA = 6,02-1023 1/моль.
– Масу одного моля речовини називають молярною масою.
– Відношення маси речовини т до кількості речовини v називається молярною масою і позначається М:
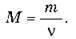
– Якщо дане тіло містить v молей речовини, то число молекул N у цьому тілі визначається виразом:
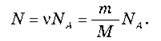
Домашнє завдання
1. Конспект.
2. Розв’язування задач:
P1): 1. Яка молярна маса гелію? урану?
2. Яка молярна маса міді? ртуті?
3. Яка маса 50 моль вуглекислого газу?
4. Яка маса атома літію? атома золота?
Р2): 1. Відомо, що 1,5-1023 молекул газу мають масу 11 г. Який це газ?
2. Яку масу мають 3-1023 атомів ртуті?
3. Чи вміститься в трилітровій банці 50 моль ртуті? Густина ртуті 13 600 кг/м3.
4. У якому об’ємі води міститься 1018 молекул (вода знаходиться в рідкому стані)?
Р3): 1. Визначте густину кисню, якщо відомо, що в об’ємі 2 л міститься 6-1022 його молекул.
2. Скільки молекул азоту знаходиться в посудині об’ємом 7 л, якщо густина азоту 2 кг/м3?
3. Яка товщина гасової плівки на поверхні води, якщо гас масою 1,6 г утворив плями площею 200 м2? Який висновок можна звідси зробити про розміри молекул? Густина гасу 800 кг/м3.
4. Під час нікелювання виробу його покривають шаром нікелю товщиною 1,5 мкм. Скільки атомів нікелю МІСТИТЬСЯ в покритті, якщо площа поверхні виробу дорівнює 800 см2? Густина нікелю 8 900 кг/м3.
3. Д.: підготуватися до самостійної роботи “Основні положення МКТ”.
ЗАВДАННЯ ДО САМОСТІЙНОЇ РОБОТИ З ТЕМИ “ОСНОВНІ ПОЛОЖЕННЯ МКТ”
Початковий рівень (1 бал)
Що є підтвердженням існування руху молекул?
А. Виникнення сил пружності при деформації твердих тіл.
Б. Броунівський рух.
В. Фотографія атомів, отриманих за допомогою електронного мікроскопа.
Г. Зчеплення молекул.
Середній рівень (2 бали)
На рисунку показано дифузію парів брому. Що являє собою дифузія?

А Хаотичний рух частинок, що зважувалися в рідині, зумовлений зіткненням з молекулами.
Б. Взаємопроникнення молекул речовин, що дотикаються, яке призводить їх до взаєного змішування.
В. Сполучення ударів молекул об поверхню колби.
Г. Стан, коли зупиняється тепловий рух молекул.
Достатній рівень (4 бали)
Метою завдання 3 є з’ясувати відповідність (логічна пара). До кожного рядка, який позначений літерою, доберіть формулу, що позначена цифрою.
A. Відносна молекулярна маса | 1. Кількість речовини, яка складається з такої ж кількості молекул, скільки атомів вуглецю міститься в 12 г вуглецю |
Б. Одиниця кількості речовини | 2. Дорівнює відношенню маси молекули даної речовини до 1/12 маси атома вуглецю |
В. Незмінна Авогадро | 3. Дорівнює масі одного моля |
Г. Молярна маса | 4. Дорівнює масі одного атому кисню |
5. Кількості молекул в одному молі |
Високий рівень (5 балів)
Скільки іонів натрія міститься в пачці вареної солі масою 500 г, яка зображена на рисунку.

