Магній – Металічні елементи головної підгрупи II групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.3. Металічні елементи головної підгрупи II групи1
8.3.2. Магній
Магній – 12-й елемент періодичної таблиці, заряд ядра – +12. Хімічний символ – Mg, відносна атомна маса – 24. Відомо три стабільні природні ізотопи Магнію: 24Mg (78,6 %), 25Mg (10,1 %), 26Mg (11,3 %). Утворює просту речовину магній. Виявляє валентність II і ступінь окиснення +2, утворює іон Mg2+.
Електронні формули:
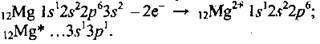
Поширеність у природі
Магній – 8-й за поширеністю елемент земної кори (1,87 % маси, тобто його кларк – майже 19 кг/т). Трапляється у вигляді мінералів магнезиту MgCO3, доломіту MgCO3 · СаСO3, карналітуMgCl2 · КСl · 6Н2O, каїніту КСl · MgSO4 · 3Н2O, бішофіту MgCl2 · 6Н2O. До складу основних порід також входять силікати: тальк 3MgO · 4SiO2 · Н2O, азбест СаО · 3MgO · 4SiO2 тощо. Багато його у морській воді – 0,12-0,13 % (саме йон Mg2+ надає їй гіркоти). Входить до складу хлорофілу (2,7 %).
Фізичні властивості магнію
Магній – пластичний сріблясто-білий метал. Його густина при 20 °С – 1,737 г/см3 (на третину менша за густину алюмінію, а міцність
Добування магнію
Магній добувають:
А) електролітичним розкладом карналіту або магній хлориду:
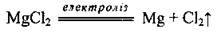
Б) відновленням з його оксиду за допомогою аморфного вуглецю за температури 2000 °С:
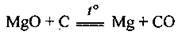
Хімічні властивості магнію
Метал дуже активний, на повітрі (подібно до алюмінію) вкривається оксидною плівкою, подальше окиснення можливе лише при нагріванні (> 300 °С). У хімічних реакціях виступає як сильний відновник. Магній реагує:
1) із простими речовинами:
– з киснем (горить яскравим полум’ям):
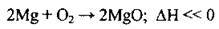
– з усіма неметалами (подібно до Кальцію):
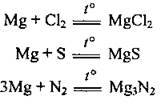
2) зі складними речовинами:
– з карбон(ІV) оксидом:
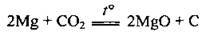
Отже, магній, який горить, не можна гасити вуглекислотним вогнегасником;
– з водою при нагріванні реагує дуже повільно через утворення малорозчинного гідроксиду:
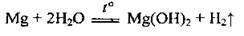
Але з водяною парою реагує легко:
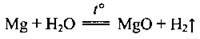
– з оксидами і галогенідами багатьох металічних елементів, легко відбираючи Оксиген і галогени:
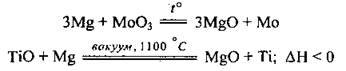
– з кислотами:
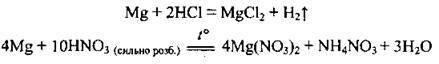




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Магній гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.4. Магній гідроксид Магній гідроксид – нерозчинна у воді речовина білого кольору. При нагріванні розкладається: Взаємодіє: – з кислотними оксидами: – з кислотами (легко): – з амфотерними оксидами (при […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...
- Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.1. Загальна характеристика Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші […]...
- Солі кальцію – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.8. Солі кальцію Якісне виявлення: іони Са2+ забарвлюють полум’я газового пальника в цегляно-червоний колір. Карбонат амонію осаджує з розчинів солей Кальцію білий осад СаСО3. Гіпс CaSО4 · 2Н2О при […]...
- Твердість води – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.9. Твердість води Твердість води зумовлена наявністю розчинних у ній солей. При використанні твердої води витрачається значно більше мийних засобів, утворюється накип на посуді та нагрівальних приладах. Дуже м’яка […]...
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- Кальцій гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.7. Кальцій гідроксид Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком. Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують […]...
- Натрій і Калій – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.2. Натрій і Калій Натрій – 11-й елемент періодичної таблиці, заряд ядра – +11. Хімічний символ – Na. Природний Натрій складається з одного стабільного ізотопу – 23Na; відомо також 6 […]...
- Калійні добрива – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.4. Калійні добрива Грунт – це верхній природний шар земної кори, основною характеристикою якого є родючість. Вона визначається багатьма факторами, зокрема вологістю та наявністю біогенних елементів2 – Нітрогену (30-50 мг/кг), […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Оксиди і гідроксиди Натрію та Калію – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.3. Оксиди і гідроксиди Натрію та Калію Оксиди Натрію та Калію – це тверді білі речовини, які виявляють основні властивості, реагуючи – з водою (утворюються луги): – з кислотами: – […]...
- ЛУЖНІ, ЛУЖНОЗЕМЕЛЬНІ ЕЛЕМЕНТИ Й МАГНІЙ. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ПРОСТИХ РЕЧОВИН, ОСНОВНИЙ ХАРАКТЕР ЇХ ОКСИДІВ І ГІДРОКСИДІВ, БІОЛОГІЧНА РОЛЬ ЕЛЕМЕНТІВ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 5. ЛУЖНІ, ЛУЖНОЗЕМЕЛЬНІ ЕЛЕМЕНТИ Й МАГНІЙ. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ПРОСТИХ РЕЧОВИН, ОСНОВНИЙ ХАРАКТЕР ЇХ ОКСИДІВ І ГІДРОКСИДІВ, БІОЛОГІЧНА РОЛЬ ЕЛЕМЕНТІВ Цілі: вивчити положення в ПС, будову атомів лужних, лужноземельних елементів і Магнію, біологічну роль цих елементів, фізичні й хімічні властивості простих речовин, утворених цими елементами; навчитися […]...
- Магній і Кальцій РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 62. Магній і Кальцій Усвідомлення змісту цього параграфа дає змогу: Характеризувати фізичні та хімічні властивості, способи добування, застосування магнію і кальцію; Складати рівняння, схеми електронного балансу відповідних хімічних реакцій. Фізичні властивості. Магній і Кальцій – сріблясто-білі, пластичні метали (мал. 109), порівняно […]...
- Сірка – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.6. Сірка Алотропні видозміни сірки Атоми Сульфуру утворюють стабільні ланцюжки і цикли. Відомо понад 10 алотропних видозмін сірки. Найстійкішими серед них є 2 модифікації (моноклінна та ромбічна), які утворені циклічними короноподібними молекулами […]...
- Силіцій – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.6. Силіцій Силіцій – 14-й елемент періодичної таблиці, заряд ядра – +14. Хімічний символ – Si, відносна атомна маса – 28. Відомо три стабільні природні ізотопи Силіцію: 28Si (92,27 %), 29Si, 30Si. […]...
- Кисень – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.3. Кисень Фізичні властивості кисню Кисень О2 – це газ без кольору, смаку і запаху, погано розчиняється у воді, зріджується за температури -183 °С (утворюється блакитна рідина), а за температури -219 °С […]...
- Нітратна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.6. Нітратна кислота Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь […]...
- Добування кальцинованої соди аміачно-хлоридним способом – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.5. Добування кальцинованої соди аміачно-хлоридним способом Концентрований розчин NaCl насичують аміаком і вуглекислим газом: NаНСО3 має низьку розчинність у холодній воді і випадає в осад, його відфільтровують і прожарюють: Тривіальні назви деяких […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- Нітроген – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.2. Нітроген Нітроген – 7-й елемент періодичної таблиці, заряд ядра – +7. Хімічний символ – N. Відносна атомна маса – 14, молярна маса – 28 г/моль. Відомо два стабільні природні ізотопи Нітрогену: […]...
- Карбон – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.2. Карбон Карбон – елемент 2-го періоду, IV групи. 6-й елемент періодичної таблиці, заряд ядра – +6. Хімічний символ – С. Відносна атомна маса – 12, молярна маса – 12 г/моль. Природний […]...
- Силіцій(ІV) оксид – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.7. Силіцій(І V ) оксид Це одна з найпоширеніших у природі сполук. Вона є основою піску, утворює мінерал кварц. Буває кристалічний (кварц і його різновиди – агат, яшма, кремінь, гірський кришталь, основа […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Сульфатна кислота – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.10. Сульфатна кислота Сульфатна кислота H2SO4 – це речовина молекулярної будови. Атом Сульфуру утворює шість ковалентних зв’язків і набуває ступеня окиснення +6: Безводна сульфатна кислота – це важка, оліїста рідина без кольору […]...
- Оксиди Карбону – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.3. Оксиди Карбону Карбон утворює два оксиди – карбон(ІІ) оксид СО та карбон(ІV) оксид СO2 зі ступенями окиснення Карбону відповідно +2 та +4. Карбон(ІІ) оксид, карбон монооксид Атом Карбону в цьому оксиді […]...
- Оксиген – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.2. Оксиген Оксиген – 8-й елемент періодичної таблиці, заряд ядра – +8. Хімічний символ – О. Відомо три стабільні природні ізотопи Оксигену: 16O,17O, 18O, серед яких найчастіше трапляється 16О (99,76 %). Оксиген […]...
- Загальна характеристика – Урок 5 – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.1. Загальна характеристика До складу головної підгрупи IV групи (14 групи) входять Карбон (С), Силіцій (Si), Германій (Ge), Станум (Sn) і Плюмбум (Рb). Будова зовнішнього електронного шару елементів – ns2nр2. Це p-елементи: […]...
- Загальні хімічні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.3. Загальні хімічні властивості металів Найтиповіша ознака металічних елементів – це здатність відносно легко віддавати електрони: 1. Взаємодія металів з простими речовинами (неметалами): А) з галогенами. Утворюються відповідні […]...
- Фосфор(V) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.10. Фосфор( V ) оксид Фосфор(V) оксид Р2O5 – твердий білий гігроскопічний (здатний вбирати вологу) порошок, сильний водо-поглинальний засіб; також може забирати воду навіть з хімічних сполук. Стійкий оксид, не виявляє окислювальних […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Аміак – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.3. Аміак Аміак (амоніак) – одна з найважливіших сполук Нітрогену. Молекула з чотирма гібридизованими sр3-орбіталями має форму майже правильного тетраедра, валентні кути (H-N-H) – 107,8°. У центрі розташований атом Нітрогену, вершину утворює […]...
- Загальна характеристика – Урок 3 – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.1. Загальна характеристика До складу головної підгрупи VI групи1 належать Оксиген, Сульфур, Селен, Телур і Полоній. Елементи цієї підгрупи ще називають халькогенами2, або елементами підгрупи Оксигену. Це p-елементи; будова зовнішнього електронного рівня […]...
- Нітроген(IV) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.5. Нітроген( IV ) оксид Нітроген утворює п’ять оксидів зі ступенями окиснення +1, +2, +3, +4 і +5. Нітроген(ІV) оксид, нітроген діоксид NO2 за стандартних умов – це газ бурого кольору1 з […]...
- Сульфур – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.5. Сульфур Сульфур – 16-й елемент періодичної таблиці, заряд ядра – +16. Хімічний символ – S, відносна атомна маса – 32. Відомо чотири стабільні природні ізотопи: 32S, 33S, 34S і 36S. Електронегативність […]...
- Загальна характеристика – Урок 4 – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.1. Загальна характеристика До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві. Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи: Валентність Нітрогену […]...
- Оксиди Сульфуру – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.8. Оксиди Сульфуру Сульфур(ІV) оксид Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. […]...
- Фосфор – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.9. Фосфор Фосфор – 15-й елемент періодичної таблиці, заряд ядра – +15. Хімічний символ – Р, відносна атомна маса – 31. У вільному стані у природі не трапляється. Штучно добутий фосфор у […]...
- Солі ортофосфатної кислоти – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.12. Солі ортофосфатної кислоти Як трьохосновна кислота Н3РO4 утворює три ряди солей: 1) середні (нормальні): К3РО4 – калій ортофосфат, Mg3(PO4)2-магній ортофосфат; І кислі: 2) однозаміщені: КН2РO4 – калій дигідрогенфосфат, Са(Н2РO4)2 – кальцій […]...
- Силікатна кислота, силікати – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.8. Силікатна кислота, силікати Силікатна кислота Н2SiO3 – це найпростіша з полі-кремнієвих кислот, склад яких виражають формулою nSiO2 · mH2O. Як правило, силікатна кислота – це суміш різних полі-кремнієвих кислот, які різняться […]...