Модель Дальтона
БУДОВА АТОМА
Згідно з уявленнями давньогрецьких вчених Левкіппа і Демокріта, матерія не може ділитися нескінченно. Має існувати найменша частинка, яка далі не ділиться, – атом (від грец. atomos – неподільний). Однак уявлення про будову атома відтоді дуже змінилося.
1. Модель Дальтона
У 1803 році Джон Дальтон звернувся до античних уявлень. Його гіпотеза про атоми включала такі положення:
– найдрібнішими частинками матерії є атоми, вони – неподільні;
– число видів атомів дорівнює числу елементів;
– атоми різних
При з’єднанні елементів їхні атоми об’єднуються в певні цілочисельні пропорції.
Оскільки маса атома настільки мала, що її неможливо визначити простим зважуванням, Дальтон вибрав масу атома Гідрогену за атомну одиницю маси, тобто він довільно прирівняв її до одиниці. Дальтон склав першу таблицю атомних мас.
На сьогодні визначення атомної одиниці маси відповідає 1/12 маси ізотопу Карбону 12С. Отже, для маси атома Гідрогену отримано значення m(Н) = 1,0079 а. о. м.
Атомна одиниця маси дуже мала: 1 а. о. м.= 0,000 000 000 000 000 000 000 001 660 565 5 г.
Увага: атомні маси всіх елементів наведено в періодичній
Оскільки, за Дальтоном, атоми і, відповідно, їхні маси під час хімічних реакцій не змінюються, його гіпотеза дозволила пояснити два сформульованих раніше фундаментальних закони хімії.
– Закон збереження маси: маса всіх речовин, що вступили в хімічну реакцію, дорівнює масі всіх продуктів реакції.
– Закон сталості складу: в хімічній сполуці елементи, що входять до неї (їхня маса), перебувають у сталому співвідношенні.
На основі цих законів і своєї гіпотези, Дальтон сформулював ще один закон хімії.
– Закон кратних відношень: якщо два елементи утворюють декілька сполук, то кількість одного елемента, що припадає в цих сполуках на одну й ту саму кількість іншого елемента, відносяться між собою як цілі числа.
Приклад. Карбон утворює два різні оксиди. Один оксид містить 42,88 % Карбону і 57,12% Оксигену, склад іншого – 27,29 % Карбону і 72,71 % Оксигену.
Нехай співвідношення числа атомів для першого оксиду буде 1:1, співвідношення мас при цьому дорівнюватиме 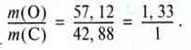
Відповідне співвідношення мас для другого оксиду дорівнюватиме 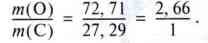
У другому оксиді зв’язано рівно вдвічі більше Оксигену, аніж у першому, тобто відношення мас зв’язаного Оксигену – 2:1.
Звідси, за Дальтоном, випливає, що співвідношення числа атомів для другого карбон оксиду дорівнює 2:1.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Відносна атомна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.4. Відносна атомна маса Сучасні методи дослідження дають змогу визначити надзвичайно малі маси атомів з високою точністю. Наприклад, маса атома гідрогену становить 1,674 ∙ 10-27 кг, оксигену – 2,667 ∙ 10-26 кг, карбону – […]...
- § 11. МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ, ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ № 1. Атомна одиниця маси (а. о. м.) – маса 1/12 частини атома Карбону, ядро якого складається з 6 протонів і 6 нейтронів. № 2, 3. Число, яке одержують діленням маси атома конкретного хімічного елемента на атомну одиницю маси (приблизно на 1,662 • 10-27 кг) має назву відносна атомна маса хімічного елемента й позначається Аr. […]...
- Вправа 65-72 № 65. Маса атома – важлива характеристика атома. Відносна атомна маса – маса атома елемента в порівнянні з 1/12 масою атома Карбону. № 67. Запис Аr – відносна атомна маса (а. о. м), Аг – символ елементу Аргону. № 68. Be → Аг = 9. Al → Аr =27. Легший атом Берилію у 3 рази. […]...
- ВІДНОСНА АТОМНА МАСА – ХІМІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ЕЛЕМЕНТ ВІДНОСНА АТОМНА МАСА У даний час за атомну одиницю маси (а. о. м.) взято 1/12 частину маси атома Карбону, а саме його ізотопу 12С. Вона складає 1,66 – 10 -24 г. У хімії застосовується безрозмірна величина – відносна атомна маса. Її можна знайти, порівнюючи маси атомів елементів з 1 […]...
- Відносна атомна маса, молекулярна маса, формульна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.6. Відносна атомна маса, молекулярна маса, формульна маса Теоретична хімія має справу з атомами і молекулами, і вираження їхньої маси у грамах для розрахунків є незручним. Так, абсолютна маса атома Гідрогену становить 1,673 ·10-24 г, атома Сульфуру – […]...
- Атомна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Атомна маса Абсолютні значення мас атомів елементів – дуже малі величини, і користуватися ними незручно. Тому в розрахунках застосовують відносні значення мас атомів. Атомною одиницею маси (а. о. м.) називається 1/12 частина маси атома Карбону. Відносною атомною масою називається число, що показує, у скільки разів маса […]...
- ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Фізика підготовка до ЗНО комплексне видання КВАНТОВА ФІЗИКА. ЕЛЕМЕНТИ ТЕОРІЇ ВІДНОСНОСТІ 3. АТОМ ТА АТОМНЕ ЯДРО 3.1. ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Резерфорд на підставі спостережень за розсіюванням α-частинок при проходженні їх через золоту фольгу обгрунтував модель атома (рис. З, а, б). Планетарна (ядерна) модель атома Резерфорда Атом складається з ядра, яке займає дуже малий об’єм […]...
- Відносна атомна маса. Відносна молекулярна маса Контрольні запитання № 1. Відносна атомна маса – це відношення маси атома даного елемента до 1/12 маси атома Карбону. Відносна молекулярна маса М показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону. Для речовин йонної будови хімічна формула відображає склад формульної одиниці. Тому для таких речовин використовують відносну формульну масу. № 2. […]...
- Маса атома. Відносна атомна маса Розділ 1 Початкові хімічні поняття 10 Маса атома. Відносна атомна маса Матеріал параграфа допоможе вам: > з’ясувати відмінність між масою атома і відносною атомною масою; > порівнювати маси атомів. Маса атома. Важливою характеристикою атома є його маса. Майже вся маса атома зосереджена в ядрі. Електрони мають настільки малу масу, що нею зазвичай нехтують. Зважувати атоми […]...
- МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ. ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ & 11. МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ. ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ Вивчення параграфа допоможе вам: · розрізняти поняття “маса атома”, “атомна одиниця маси”, “відносна атомна маса хімічного елемента”; · порівнювати масу атомів. МАСА АТОМА. Як ваді відомо з попереднього параграфи, атоми мають вражаюче малі розміри. Відповідно й маса атомів […]...
- Рівняння хімічних реакцій. Закон збереження маси речовин у хімічних реакціях Контрольні запитання № 1. Маси речовин, що вступають у реакцію, дорівнюють масі утворених речовин, про що свідчить закон збереження маси в хімічних реакціях. Цей закон підкріплений тим, що атоми в хімічних реакціях не зникають, а просто переходять з одних речовин до складу інших. За допомогою хімічних символів і знаків закон збереження маси відображають рівнянням хімічної […]...
- Відносна молекулярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.5. Відносна молекулярна маса Відносною молекулярною масою Мr речовини називається величина, що дорівнює відношенню середньої маси молекули природного ізотопічного складу речовини до маси атома карбону 12С. Відносна молекулярна маса чисельно дорівнює сумі відносних атомних […]...
- Кількісний аналіз – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.2. Кількісний аналіз Для кількісного аналізу речовини береться точно зважена кількість речовини і непрямим шляхом визначається маса елементів, зв’язаних у речовині. Якщо речовина складається тільки з Карбону, Гідрогену й Оксигену, то вона повністю окислюється повітрям або киснем і купрум оксидом до СО2 і Н2О. Вода абсорбується в ємкості, заповненій сухим кальцій хлоридом, […]...
- Структура карбонільної групи – Альдегіди і кетони КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 4 . Альдегіди і кетони 4.2 . Структура карбонільної групи Атом Оксигену й атом Карбону карбонільної групи знаходяться в sр2-гібридному стані. Вони розташовані в одній площині з двома сусідніми атомами Карбону. Перпендикулярно до цієї площини знаходяться р-орбіталі атома Карбону й атома Оксигену, які, перекриваючись, утворюють π-зв’язок. На відміну від подвійного зв’язку алкенів, […]...
- МАСА АТОМІВ І МОЛЕКУЛ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.3. МАСА АТОМІВ І МОЛЕКУЛ Маси атомів і молекул прийнято порівнювати з 1/12 маси атома ізотопу Карбону 126С. Відносною молекулярною масою Мr називають відношення маси молекули mo до 1/12 маси атома Карбону m0с (атомної одиниці маси, а. о. м.): Де Мr […]...
- Вправа 89-94 № 89. Коефіцієнт – цифра перед хімічною формулою, позначає кількість молекул речовини. 2O2 – дві молекули кисню; 3Сu – три атоми міді. Індекс – маленька цифра, записана нижче і справа від символу елементу. Показує кількість атомів елементів, які входять до складу молекули. Н2O – молекула води складається з 2 атомів Гідрогену і одного атому Оксигену. […]...
- Відносні атомні маси хімічних елементів Тема 1 Початкові хімічні поняття & 7. Відносні атомні маси хімічних елементів Опанувавши цю тему, ви зможете: – розуміти кількісну характеристику атома; – розрізняти поняття “відносна атомна маса” і “маса атома”; – знати одиницю, щодо якої обчислюють відносні атомні маси елементів, а також першу класифікацію елементів на металічні й неметалічні; – уміти знаходити значення відносних […]...
- Ядерна модель будови атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.3. Ядерна модель будови атомів До кінця XIX ст. атоми вважалися неподільними. Потім, з нагромадженням експериментальних даних, довелося відмовитися від такого погляду і визнати, що атоми мають складну будову. Новий погляд […]...
- Кількість речовини, молярна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.7. Кількість речовини, молярна маса Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль. Моль – […]...
- Відносна молекулярна маса Розділ 1 Початкові хімічні поняття 15 Відносна молекулярна маса Матеріал параграфа допоможе вам: > з’ясувати, що таке відносна молекулярна маса; > навчитись обчислювати відносні молекулярні маси. Маси молекул, як і атомів, надзвичайно малі. Тому в хімії використовують відносні маси молекул. Їх зазвичай називають відносними молекулярними масами. Відносна молекулярна маса – це відношення маси молекули до […]...
- Склад атома Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Склад атома Атоми складаються з позитивно зарядженого ядра та електронів. Електрон – найлегший з відомих елементарних частинок. Його маса (9,1 ∙ 10-31 кг) У 1837 разів менша від маси найлегшого з атомів – атома Гідрогену. Електричний заряд електрона називають елементарним – […]...
- Модель Томсона БУДОВА АТОМА 2. Модель Томсона Досліди Майкла Фарадея з електролізу в 1833 році та відкриття електрона Дж. Дж. Стоні в 1881 році вже неможливо було пояснити простою моделлю Дальтона. Дж. Дж. Томсон у 1904 році запропонував модель атома, що включала поняття заряду. – Атом складається з кулі, що має позитивний електричний заряд, в якій розміщені […]...
- Валентність Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Валентність При утворенні молекули атоми не просто об’єднуються в якийсь безладний клубок, а зв’язуються в певній послідовності особливими хімічними зв’язками. Причому кожен атом може утворити не нескінченне, а тільки певне число таких зв’язків. У XIX столітті вчені встановили, […]...
- Ядерна модель (модель Резерфорда) БУДОВА АТОМА 3. Ядерна модель (модель Резерфорда) При опроміненні найтоншої золотої фольги α-частинками більшість частинок проходить через фольгу по прямій лінії, деякі з них відхиляються на різні кути, а приблизно 1 частинка зі 100 000 відбивається назад. Результати цього експерименту з розсіювання α-частинок, проведеного в 1911 році, неможливо пояснити моделлю Томсона. Ядерна модель Резерфорда заперечує […]...
- ЗАКОН ДАЛЬТОНА – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) 2.3. ЗАКОН ДАЛЬТОНА Закон Дальтона: тиск суміші газів дорівнює сумі парціальних тисків складових газів: Парціальний тиск – це тиск, який створював би газ, якби він займав даний об’єм сам....
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Тема 1. Атомно-молекулярна будова речовини – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 1. Атомно-молекулярна будова речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте визначення атома: A. Найменша частинка, що входить до складу молекули і зберігає її властивості; Б. Електронейтральна частинка речовини, що […]...
- Поняття про альдегіди – АЛЬДЕГІДИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛЬДЕГІДИ Поняття про альдегіди До альдегідів належать сполуки, які у своєму складі містять альдегідну групу. Альдегідна група є функціональною групою альдегідів: Скорочено альдегідну групу записують: – СНО. Найпростішим альдегідом є мурашиний альдегід, у молекулі якого до альдегідної групи приєднаний атом Гідрогену, […]...
- Характеристика хімічних елементів за положенням у періодичній системі хімічних елементів і будовою атома Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 52 Тема. Характеристика хімічних елементів за положенням у періодичній системі хімічних елементів і будовою атома Цілі уроку: закріпити вміння й навички характеризувати елементи за їх положенням у періодичній системі й будовою атома; підготувати учнів до тематичного оцінювання з теми “Періодичний […]...
- Хімічні формули речовин № 1. Хімічна формула – це умовний запис складу речовини за допомогою символів хімічних елементів та індексів. За допомогою хімічних формул записують склад речовин. № 2. Індекс показує число атомів в молекулі. Індекс записується маленькою цифрою праворуч від символа елемента. № 3,4. Для речовин молекулярної будови хімічна формула відображає склад молекули речовини, а для речовин […]...
- ОКСИГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ОКСИДИ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ОКСИГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ОКСИДИ Хімічний символ Оксигену – О. Його відносна атомна маса 15,9994 ≈ 16. Елемент О знаходиться в VIA групі періодичної системи, отже, можливі його валентності – вища 6 і нижча 2. Але правіше від Оксигену в таблиці розташований лише один елемент F, а вище – жодного. […]...
- АТОМИ Розділ 2. БУДОВА РЕЧОВИНИ §8 . АТОМИ ТА МОЛЕКУЛИ 1. АТОМИ Тіла складаються з речовини. Питання про будову речовини цікавило вчених ще з далекої давнини. Одні вчені вважали, що речовину можна ділити на менші частини нескінченно. Наприклад, казали вони, краплю води можна дробити скільки завгодно, але найдрібніші краплі все одно залишаються краплями води! І межі […]...
- Обчислення молекулярної маси речовини й масових часток елементів у ній ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 13. Обчислення молекулярної маси речовини й масових часток елементів у ній Цілі: узагальнити знання учнів про зміст хімічної формули; розвивати вміння учнів обчислювати молекулярну масу речовини й масову частку елементів за хімічною формулою; виховувати прагнення працювати самостійно. Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва; дидактичний матеріал: картки із […]...
- ЗАКОН ЗБЕРЕЖЕННЯ МАСИ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ ЗАКОН ЗБЕРЕЖЕННЯ МАСИ Рівняння хімічної реакції – це, фактично, рівняння матеріального балансу речовин, що вступили в реакцію, і продуктів реакції, тобто рівність їхніх мас. Дійсно, число атомів кожного елемента зліва і справа в рівнянні реакції те ж саме, адже атоми в хімічних реакціях не виникають і не […]...
- Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.2. Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин Атомно-молекулярне вчення – це сукупність аксіом і законів, що розглядають речовину, яка складається з атомів. Ось основні його положення: – усі речовини складаються з атомів. Молекули простих речовин складаються з […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- Закон сталості складу речовини ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.10. Закон сталості складу речовини До основних законів хімії належить закон сталості складу: Кожна чиста речовина незалежно від способу її добування завжди має сталий якісний і кількісний склад. Розглянемо, наприклад, склад оксиду карбону(ІV) (вуглекислого […]...
- Виведення формули сполуки – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач VI. Виведення формули сполуки Зауважимо, що співвідношення значень індексів у формулі речовини дорівнює співвідношенню кількості атомів елементів у сполуці та відповідно співвідношенню кількостей речовини елементів. Отже, для речовини, формула якої Р2O5, можна записати: Якщо […]...
- РОЗРАХУНКИ ЗА ХІМІЧНОЮ ФОРМУЛОЮ – ХІМІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ЕЛЕМЕНТ РОЗРАХУНКИ ЗА ХІМІЧНОЮ ФОРМУЛОЮ Знаючи хімічну формулу речовини, можна розрахувати відносний вміст кожного елемента у зразку речовини за його масою. Наприклад, визначимо масову частку Алюмінію в його сполуці з Оксигеном – оксиді алюмінію (глиноземі) Аl2O3. Знайти масову частку Алюмінію – означає вирахувати, яку частку складає маса Алюмінію від усієї […]...
- Атомна одиниця маси. Відносна атомна маса хімічних елементів Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 8 Тема. Атомна одиниця маси. Відносна атомна маса хімічних елементів Цілі уроку: розширити знання учнів про періодичну систему елементів; закріпити знання учнів про хімічний елемент, хімічну символіку; ознайомити учнів з поняттям абсолютної та відносної атомної маси, одиницею вимірювання відносної атомної маси – атомною одиницею маси (а. о. м.); навчити […]...