Молярний об’єм газів. Обчислення об’єму газу за нормальних умов
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 7
Тема. Молярний об’єм газів. Обчислення об’єму газу за нормальних умов
Цілі уроку: ознайомити учнів з поняттям “молярний об’єм”; розкрити особливості використання поняття “молярний об’єм” для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов.
Тип уроку: комбінований.
Форми роботи: розповідь учителя, керована практика.
Обладнання: Періодична система хімічних
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Учні здають на перевірку виконане на аркушах домашнє завдання.
Фронтальна бесіда
1) Що таке “кількість речовини”?
2) Одиниця вимірювання кількості речовини.
3) Скільки частинок міститься в 1 моль речовини?
4) Яка існує залежність між кількістю речовини й агрегатного стану, в якому перебуває ця речовина?
5) Скільки молекул води міститься в 1 моль льоду?
6) А в 1 моль рідкої води?
7) В 1 моль водяної
8) Яку масу матимуть:
– 1 моль льоду?
– 1 моль води?
– 1 моль пари?
III. Вивчення нового матеріалу
Створення й розв’язання проблемної ситуації Проблемне питання. Який об’єм займатиме:
– 1 моль льоду?
– 1 моль води?
– 1 моль пари?
Відповісти на ці запитання відразу ми не можемо, тому що об’єм речовини залежить від густини речовини. І згідно з формулою V = m/?, об’єм буде різним. 1 моль пари займає об’єм більший, ніж 1 моль води або льоду.
Чому?
Тому, що в рідких і газоподібних речовинах відстань між молекулами води різна.
Вивченням газоподібних речовин займалося безліч учених. Значний внесок у вивчення цього питання зробили французький хімік Жозеф Луї Гей-Люссак та англійський фізик Роберт Бойль, які сформулювали низку фізичних закономірностей, що описують стан газів.
Які з цих закономірностей ви знаєте?
Усі гази однаково стискаються, мають однаковий термічний коефіцієнт розширення. Об’єми газів залежать не від розмірів окремих молекул, а від відстані між молекулами. Відстані між молекулами залежать від швидкості їхнього руху, енергії та, відповідно, температури.
На підставі цих законів і своїх досліджень італійський учений Амедео Авогадро сформулював закон:
В однакових об’ємах різних газів міститься однакова кількість молекул.
За звичайних умов газоподібні речовини мають молекулярну будову. Молекули газів дуже дрібні порівняно з відстанню між ними. Тому об’єм газу визначається не розміром частинок (молекул), а відстанню між ними, що для будь-якого газу приблизно однакова.
А. Авогадро зробив висновок, що, якщо взяти 1 моль, тобто 6,02 – 1023 молекул будь-яких газів, то вони займатимуть однаковий об’єм. Але при цьому вимірюватися цей об’єм має за однакових умов, тобто за однакових температури й тиску.
Умови, за яких проводяться подібні розрахунки, назвали нормальними умовами.
Нормальні умови (н. у.):
Т= 273 К або t = 0 °С
Р = 101,3 кПа або Р = 1 атм. = 760 мм рт. ст.
Об’єм 1 моль речовини називають молярним об’ємом (Vm). Для газів за нормальних умов він дорівнює 22,4 л/моль.
Демонструється куб об’ємом 22,4 л.
У такому кубі міститься 6,02-1023 молекул будь-яких газів, наприклад, кисню, водню, амоніаку (NH3), метану (СН4).
За яких умов?
За температури 0 °С і тиску 760 мм рт. ст.
Із закону Авогадро випливає, що
V =  – Vm;
– Vm;
Отже,
 = V/Vm,
= V/Vm,
Де Vm = 22,4 л/моль для будь-якого газу за н. у.
Отже, знаючи об’єм газу, можна обчислити кількість речовини, і навпаки.
IV. Формування навичок і вмінь
Практика на прикладах
Задача 1
Обчисліть, який об’єм займатимуть 3 моль кисню за н. у.
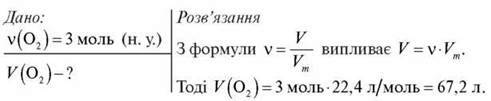
Відповідь: 67,2 л.
Задача 3
Обчисліть кількість молекул карбон(IV) оксиду в об’ємі 44,8 л (н. у).
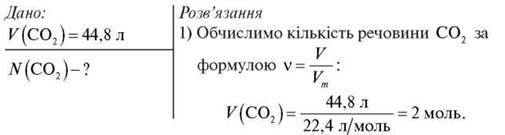
2) Обчислимо кількість молекул СO2 за формулами:
 = N/NA; N =
= N/NA; N =  – NA,
– NA,
N(CO2) = 2 моль – 6,02 – 1023 молекул/моль = 12,04 – 1023 молекул.
Відповідь: 12,04 – 1023 молекул.
Задача 5
Обчисліть, який об’єм займає азот масою 112 г (за н. у.).

2) За формулами  = V/Vm, V =
= V/Vm, V =  – Vm обчислимо об’єм N2:
– Vm обчислимо об’єм N2:
V(N2) = 4 моль – 22,4 л/моль = 89,6 л.
Відповідь: 89,6 л.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання.
Творче завдання (домашня практика). Самостійно розв’язати задачі 2, 4, 6 з картки.
Картка-завдання до уроку 7
Задача 2
Обчисліть, який об’єм займе 7 моль азоту N2 (за н. у.).
(Відповідь: 156,8 л)
Задача 4
Обчисліть кількість молекул водню об’ємом 112 л.
(Відповідь: 30,1 – 1023 молекул)
Задача 6
Обчисліть, який об’єм займає сірководень масою 340 г.
(Відповідь: 224 л)
