Оксид та гідроксид алюмінію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП
§ 13.12. Оксид та гідроксид алюмінію
Оксид алюмінію (глинозем) Аl2О3 – речовина білого кольору, досить тугоплавка, з дуже високою твердістю. Є вихідним продуктом для добування алюмінію. У природі трапляється у вигляді корунду та його різновидів. Якщо безбарвні кристали корунду забарвлені домішками в синій колір, вони називаються сапфірами, у фіолетовий – аметистами, у червоний – рубінами. Кристали рубінів
У лабораторії оксид алюмінію добувають спалюванням алюмінію у кисні або прожарюванням гідроксиду алюмінію: 4Аl + 3O2 = 2Аl2О3; 2Аl(ОН)3 = Аl2О3 + ЗН2О.
У промисловості, як уже зазначалося, його добувають з бокситів або нефелінів.
Оксид алюмінію не розчиняється у воді і з нею не реагує. Він амфотерний – взаємодіє з кислотами (правда, важко) і лугами:
А) з хлоридною кислотою:
Аl2О3 + 6НСl = 2АlСlЗ + ЗН2O;
Б) при сплавлянні з твердим гідроксидом натрію:
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О;
В) з розчином гідроксиду натрію:
Аl2О3 + 2NaOH + 7Н2О = 2Na
Або
Аl2О3
Розчинення амфотерних гідроксидів у лужних розчинах розглядають як процес утворення гідроксосолей (гідроксоком плексів). Експериментально доведено існування гідроксокомплексів
-, 3-, 2-;
З них перший – найстійкіший. Координаційне число алюмінію в цьому комплексі дорівнює 6, тобто алюміній є шестикоординованим:
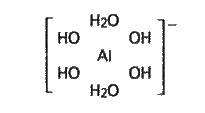
Тому взаємодію гідроксиду алюмінію з розчином лугу слід зображати рівнянням (в).
Дисоціацію амфотерного гідроксиду алюмінію у водному розчині точніше можна виразити рівнянням:
Аl3+ + 3ОН – ⇆ Аl(OН)3 = Аl(OН)3 + 3Н2О ⇆ + H+.
Гідроксид алюмінію Аl(OН)3 – біла тверда речовина, у воді практично нерозчинна. Добувають його непрямим способом – із солей алюмінію дією на них розчинами лугів:
АlСl3 + 3NaOH = Аl(OН)3 ↓ + 3NaCl
Або
Al3+ +3OН – = Аl(OН)3 ↓.
Аl(ОН)3 – типовий амфотерний гідроксид. При взаємодії з кислотами утворює солі, що містять катіони алюмінію; при взаємодії з розчинами лугів (взятими у надлишку) утворює алюмінати, тобто солі, в яких алюміній входить до складу аніона. Наприклад:
Аl(ОН)3 + ЗН+ = Аl3+ + ЗН2О;
Аl(ОН)3 + ОН – + 2Н2O = -.
Як видно з рівняння дисоціації Аl(ОН)3, при надлишку іонів Н+ (тобто в кислому середовищі) у водному розчині переважають іони Аl, а у лужному середовищі утворюється переважно однозарядний аніон, він же і найстійкіший.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Оксид і гідроксид кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.7. Оксид і гідроксид кальцію Оксид кальцію (технічні назви: негашене вапно, палене вапно, кипілка) – порошок білого кольору. У промисловості його добувають випалюванням вапняку, крейди чи інших карбонатних порід: СаСО3 = СаО + СО3; ∆Н° = […]...
- Алюміній. Алюміній оксид і алюміній гідроксид, їх амфотерність – Метали Хімія Неорганічна хімія Метали Алюміній. Алюміній оксид і алюміній гідроксид, їх амфотерність Алюміній Алюміній Розташований в IIIА групі (III групі, головній підгрупі) Періодичної системи. Електронна конфігурація атома Алюмінію: На зовнішньому енергетичному рівні три електрони, ступінь окиснення в сполуках +3. Алюміній – найпоширеніший метал у земній корі. Зустрічається тільки у вигляді сполук (алюмосилікати, боксити, корунд, кріоліт). […]...
- Застосування алюмінію та його сплавів – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.13. Застосування алюмінію та його сплавів Фізичні та хімічні властивості алюмінію зумовили його широке застосування в техніці. Значним споживачем алюмінію є авіаційна промисловість: літак на складається з алюмінію та його сплавів, а авіацшнии двигун – на […]...
- Алюміній. Алюміній оксид, алюміній гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 30 Тема уроку. Алюміній. Алюміній оксид, алюміній гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію Цілі уроку: розширити й поглибити знання учнів про метали на прикладі Алюмінію – представника головної підгрупи ІІІ групи; повторити поняття амфотерності на прикладі сполук Алюмінію, їх хімічних […]...
- Оксиди та гідроксиди хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.3. Оксиди та гідроксиди хрому Хром утворює три оксиди: СrО, Сr2О3 та СrО3. Оксид хрому(ІІ) СrО – пірофорний чорний порошок (пірофорність – здатність в тонкоподрібненому стані займатися на повітрі). Добувають його окисненням амальгами хрому киснем повітря. […]...
- Алюміній – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.11. Алюміній Природні сполуки алюмінію. Алюміній належить до найпоширеніших елементів. Серед металів за поширенням у природі він посідає перше місце. Загальний вміст алюмінію в земній корі становить 8,8 %. Найважливіші природні сполуки алюмінію – алюмосилікати, боксит, […]...
- Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.3. Їдкі луги Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН. Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості […]...
- Сполуки Алюмінію РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 66. Сполуки Алюмінію Усвідомлення змісту цього параграфа дає змогу: Характеризувати фізичні та хімічні властивості оксиду, гідроксиду і солей Алюмінію; їх добування і застосування; Складати рівняння та схеми електронного балансу відповідних хімічних реакцій; Добувати експериментально алюміній гідроксид, доводити його амфотерні властивості. До […]...
- Кальцій. Кальцій гідроксид і кальцій оксид – Метали Хімія Неорганічна хімія Метали Кальцій. Кальцій гідроксид і кальцій оксид Кальцій Кальцій Розташований у IIА групі (II групі, головній підгрупі), 4 періоді Періодичної системи. Він належить до лужноземельних металів. Електронна конфігурація атома Кальцію: На зовнішньому енергетичному рівні розміщені два електрони; ступінь окиснення Кальцію в сполуках +2. У вільному вигляді Кальцій у природі не зустрічається, поширений […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...
- Натрій і калій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.2. Натрій і калій Поширення в природі. В природі лужні метали у вільному стані не трапляються. Натрій і калій входять до складу різних сполук. Найважливішою є сполука натрію з хлором NaCl, яка утворює поклади кам’яної солі […]...
- Кальцій гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.7. Кальцій гідроксид Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком. Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують […]...
- Солі кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.8. Солі кальцію Карбонат кальцію широко розповсюджений в природі у вигляді гірської породи – вапняку. Багато гірських хребтів складаються з вапняку і крейди. Часто трапляється і мармур, що утворився у давні геологічні епохи з вапняку і […]...
- Сполуки заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.7. Сполуки заліза Для заліза найбільш характерні два ряди сполук: сполуки феруму(ІІ) і феруму(ІІІ). Відома також незначна кількість сполук феруму(VІ) – ферати, наприклад ферат калію K3FeO4, ферат барію BaFeO4. Оксид ферум у (II) FeO – чорний […]...
- Твердість води та способи її усунення – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.9. Твердість води та способи її усунення У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості. Твердість води – сукупність […]...
- Кальцій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.6. Кальцій Поширення у природі. Кальцій належить до поширених елементів. Загальний вміст його в земній корі становить 3,6 %. У природі найбільш розповсюджені такі сполуки кальцію: мінерал кальцит СаСО3 (з нього утворені масиви вапняку, мармуру і […]...
- Солі Алюмінію – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній 8.4.3. Солі Алюмінію Алюміній утворює солі всіх типів з відомими неорганічними кислотами. Зазначимо, що йон Аl3+ здатний до комплексоутворення завдяки великому заряду та наявності вакантних орбіталей: Середні Кислі Основні Подвійні (галуни) Комплексні АlСl3, Al2(SO4)3 […]...
- Алюміній гідроксид – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній 8.4.2. Алюміній гідроксид Алюміній гідроксид – це біла тверда речовина, яка не розчиняється у воді. Це амфотерна основа. Лише свіжоосаджений алюміній гідроксид розчиняється в лугах та кислотах: А в розчині утворюються комплексні солі: При […]...
- ГІДРОКСИД НАТРІЮ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ГІДРОКСИД НАТРІЮ Гідроксид натрію NаОН широко відомий під назвою їдкий натр. Цю назву (історично вона була першою) він отримав завдяки високій хімічній активності стосовно тваринних тканин – “їдкості” (як і гідроксиди всіх інших лужних металів). Його технічна назва – каустична сода. Гідроксид натрію – розчинна у воді основа, тобто […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 29 Тема уроку. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію Цілі уроку: розширити знання учнів про метали на прикладі лужноземельних металів; вивчити властивості лужноземельних металів, їхніх сполук, способи одержання й застосування на прикладі Кальцію; продовжити […]...
- Хром – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.2. Хром Поширення у природі. Хром трапляється у вигляді сполук у різних мінералах. Найпоширеніший мінерал хроміт, або хромистий залізняк FeCr2O4, багаті родовища якого є на Уралі і в Казахстані. Загальний вміст хрому в земній корі становить […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Ферум. Оксиди й гідроксиди Феруму – Метали Хімія Неорганічна хімія Метали Ферум. Оксиди й гідроксиди Феруму Ферум Елемент Ферум Розташований в VIIIБ групі (VIII групі, побічній підгрупі), у 4 періоді. Електронна конфігурація атома Феруму: Валентними у Феруму є електрони як останнього, так і передостаннього рівня d-підрівня. Найхарактерніші ступені окиснення у сполуках +2 і +3. Ферум – другий за поширеністю в природі метал […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- ВИВЧЕННЯ АМФОТЕРНИХ ВЛАСТИВОСТЕЙ АЛЮМІНІЮ, АЛЮМІНІЙ ОКСИДУ Й АЛЮМІНІЙ ГІДРОКСИДУ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 12. ВИВЧЕННЯ АМФОТЕРНИХ ВЛАСТИВОСТЕЙ АЛЮМІНІЮ, АЛЮМІНІЙ ОКСИДУ Й АЛЮМІНІЙ ГІДРОКСИДУ Цілі: закріпити знання про алюміній та його сполуки, уміння давати характеристику Алюмінію за положенням у ПС і будовою атома, характеризувати його фізичні й хімічні властивості; розглянути способи добування, фізичні властивості алюміній оксиду й алюміній гідроксиду; складати рівняння […]...
- Хромати і дихромати – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.4. Хромати і дихромати Хромові кислоти утворюють два ряди солей: хромати – так називаються солі хроматної кислоти – і дихромати – так називаються солі дихроматної кислоти. Хромати мають жовте забарвлення (колір хромат-іона Сr2-4 ), дихромати – […]...
- Магній гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.4. Магній гідроксид Магній гідроксид – нерозчинна у воді речовина білого кольору. При нагріванні розкладається: Взаємодіє: – з кислотними оксидами: – з кислотами (легко): – з амфотерними оксидами (при […]...
- Доменний процес – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.8. Доменний процес Добування заліза з руд грунтується на відновленні його оксидів оксидом карбону(ІІ) та вугіллям (коксом). При цьому утворюється не чисте залізо, а сплав його з вугіллям та іншими домішками (кремнієм, марганцем, сіркою, фосфором). Цей […]...
- Зв’язок між класами неорганічних сполук – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.6. Зв’язок між класами неорганічних сполук Між простими речовинами, оксидами, кислотами, основами і солями існує генетичний зв’язок, а саме – можливість їх взаємного переходу. Наприклад, проста речовина метал кальцій внаслідок сполучення його з киснем перетворюється […]...
- Алюміній оксид – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній Алюміній – елемент головної підгрупи III групи періодичної таблиці, заряд ядра – +13. Хімічний символ – Аl, відносна атомна маса – 27. Природний алюміній майже повністю складається з єдиного стабільного ізотопу 27Аl зі слідами […]...
- Залізо – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14. 6 . Залізо Найважливіші руди заліза. Залізо після алюмінію – найпоширеніший у природі метал. Загальний вміст його в земній корі становить 5,1 %. Залізо входить до складу багатьох мінералів. Найважливішими залізними рудами є: 1) магнітний […]...
- АЛЮМІНІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ АЛЮМІНІЙ Алюміній – третій за поширеністю елемент земної кори. Він входить до складу багатьох силікатних мінералів, які називаються алюмосилікатами. Найважливішою природною сполукою алюмінію, що стала сировиною для виробництва металу, є боксит – гідратований оксид алюмінію. Алюміній – дуже активний метал. У ряді активності металів він стоїть лівіше багатьох […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- МЕТАЛИ ТА СПЛАВИ В СУЧАСНІЙ ТЕХНІЦІ. ЗАСТОСУВАННЯ АЛЮМІНІЮ, ЗАЛІЗА ТА ЇХ СПЛАВІВ. РОЗВИТОК МЕТАЛУРГІЙНИХ ВИРОБНИЦТВ В УКРАЇНІ. ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА ПІД ЧАС ВИРОБНИЦТВА ТА ВИКОРИСТАННЯ МЕТАЛІВ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 14. МЕТАЛИ ТА СПЛАВИ В СУЧАСНІЙ ТЕХНІЦІ. ЗАСТОСУВАННЯ АЛЮМІНІЮ, ЗАЛІЗА ТА ЇХ СПЛАВІВ. РОЗВИТОК МЕТАЛУРГІЙНИХ ВИРОБНИЦТВ В УКРАЇНІ. ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА ПІД ЧАС ВИРОБНИЦТВА ТА ВИКОРИСТАННЯ МЕТАЛІВ Цілі: ознайомитися з поняттям про сплави, розглянути роль металів і сплавів у сучасній техніці; закріпити знання про застосування алюмінію, заліза […]...
- Нітроген(IV) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.5. Нітроген( IV ) оксид Нітроген утворює п’ять оксидів зі ступенями окиснення +1, +2, +3, +4 і +5. Нітроген(ІV) оксид, нітроген діоксид NO2 за стандартних умов – це газ бурого кольору1 з […]...
- Чавун і сталі – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.9. Чавун і сталі Виплавлений у домні чавун містить феруму близько 93 %, карбону до 4,5 %, силіцію 0,5-2 %, мангану 1-3 %, фосфору 0,02-2,5 % і сульфуру 0,005-0,08 %. Чавун крихкий, не піддається куванню і […]...