Опис швидкості реакції – Швидкість реакції
ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
2. Швидкість реакції
2.3 . Опис швидкості реакції
Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t).
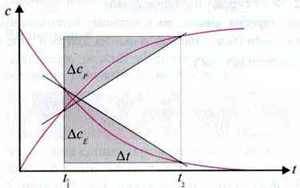
В один і той самий проміжок часу ∆t нахили січних однакові, проте мають різні знаки. Між двома виразами для визначення швидкості реакції існує такий взаємозв’язок:
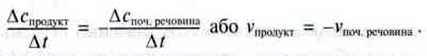
Проте ці вирази дійсні лише для реакції, при якій кількість початкової речовини або продукту реакції за один і той самий проміжок часу зменшується або збільшується на одну й ту саму величину:
А + В → С + D.
У реакціях, які не відповідають даному зразку, для визначення швидкості реакції потрібно враховувати стехіометричні коефіцієнти:
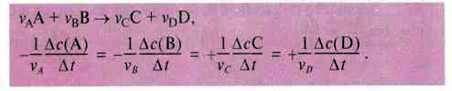
Приклад. Водень і йод реагують між собою, утворюючи гідроген йодид:
Н2 + I2 → 2НІ.
У результаті реакції одного моля водню й одного моля йоду утворюються два молі гідроген йодиду. Вираз швидкості реакції можна записати
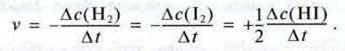




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Середня і миттєва швидкість – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.2 . Середня і миттєва швидкість У ході реакції її швидкість зазвичай зменшується. Тобто швидкість реакції непостійна. Наведені вище значення швидкості є лише середніми значеннями. Математично середня швидкість у певному інтервалі часу між t1 і t2 визначається з нахилу січної на діаграмі залежності концентрації від часу. Увага: при експериментальному […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- ПОНЯТТЯ ПРО ШВИДКІСТЬ. ЗАДАЧІ НА ЗНАХОДЖЕННЯ ШВИДКОСТІ ОРІЄНТОВНА НАВЧАЛЬНА МЕТА: ОЗНАЙОМИТИ З ПОНЯТТЯМ “ШВИДКІСТЬ РУХУ”, ПРОСТИМИ Й СКЛАДЕНИМИ ЗАДАЧАМИ НА ЗНАХОДЖЕННЯ ШВИДКОСТІ I. Перевірка домашнього завдання Задачу 489 розв’язують на дошці, замінивши число 1400 числом 1800. Чи змінилися план і вибір дії у розв’язанні? Вправу 488 перевірити фронтально. II. Актуалізація та корекція знань учнів 1. Завдання для опитування. 1) У скільки разів […]...
- ПОНЯТТЯ ПРО ШВИДКІСТЬ. ЗАДАЧІ НА ЗНАХОДЖЕННЯ ШВИДКОСТІ РУХУ. ЗАЛЕЖНІСТЬ ШВИДКОСТІ ВІД ЗМІНИ ВІДСТАНІ ПРИ СТАЛОМУ ЧАСІ Мета: ознайомити учнів з поняттям “швидкість руху”, скороченим позначенням швидкості при числах, простими і складеними задачами на знаходження швидкості; розвивати навички усних та письмових обчислень; виховувати інтерес до предмета. ХІД УРОКУ I. ОРГАНІЗАЦІЙНИЙ МОМЕНТ II. КОНТРОЛЬ, КОРЕКЦІЯ І ЗАКРІПЛЕННЯ ЗНАНЬ 1. Перевірка домашнього завдання 2. Усні обчислення Гра “Ланцюжок” – Запишіть відповіді в порядку зростання […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Аналіз тематичного опитування. Поняття про швидкість. Задачі на знаходження швидкості руху (№№ 490-499) Тема. Аналіз тематичного опитування. Поняття про швидкість. Задачі на знаходження швидкості руху (№№ 490-499). Мета. Провести аналіз тематичного опитування; з’ясувати типові помилки; організувати роботу над помилками; ознайомити учнів з поняттям “швидкість руху”, простими і складеними задачами на знаходження швидкості. Обладнання. Таблиця “Швидкість. Час. Відстань”; схеми задач. Зміст уроку 1. Аналіз тематичного опитування. 1. Загальна характеристика […]...
- Реакції рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги Багато хімічних реакцій оборотні. В якому напрямі вони проходитимуть залежить від наявних умов, наприклад, від температури. 1.1. Реакції рівноваги В оборотних реакціях за певних і постійних умов можуть проходити як пряма, так і зворотна реакції. Приклад. Суміш газоподібного йоду і водню реагує при підвищеній температурі, утворюючи гідроген йодид. Н2 […]...
- Поняття про швидкість. Задачі на знаходження швидкості руху УРОК 46 Тема. Поняття про швидкість. Задачі на знаходження швидкості руху Мета: пояснити правило знаходження швидкості руху за даними відстанню і часом руху; вправляти учнів у виконанні дій над іменованими числами. Обладнання: креслення й таблиці до задач. ХІД УРОКУ I. Контроль і закріплення знань учнів Усні обчислення. 1. Гра “Естафета” 1-й ряд 2-й ряд 3-й […]...
- ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Швидкість реакції – це кількість речовини, що реагує за одиницю часу. Залежно від умов одна і та ж реакція може протікати з різною швидкістю. Так, при збільшенні кількості речовини, що реагує в одиниці об’єму, тобто його концентрації, швидкість реакції зростає, тому що зростає число зіткнень частинок, що […]...
- Рівномірний прямолінійний рух. Швидкість рівномірного прямолінійного руху МЕХАНІКА РОЗДІЛ 2. МЕХАНІЧНИЙ РУХ § 17. Рівномірний прямолінійний рух. Швидкість рівномірного прямолінійного руху Запитання до вивченого 1. Рівномірним рухом називають такий рух, під час якого тіло за будь-які однакові інтервали часу проходить однаковий шлях. Прикладом рівномірного руху є рух точки земної поверхні під час обертання Землі навколо своєї осі. За рівномірний рух можна прийняти […]...
- Швидкість хімічних реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.1. Швидкість хімічних реакцій Суть хімічних реакцій зводиться до розриву зв’язків у вихідних речовинах і виникнення нових зв’язків у продуктах реакції. При цьому загальне число атомів кожного елемента до і після реакції залишається сталим. Оскільки утворення […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- Космічні швидкості – Динаміка 5. Механіка 5.2. Динаміка 5.2.19. Космічні швидкості Космічні швидкості – мінімальні швидкості космічного апарата, за яких він може: 1) стати супутником планети – перша космічна швидкість. Для супутників Землі: Де R – радіус Землі, або , де M – маса Землі; r – відстань від центра Землі до точки простору, де тіло набуває першої космічної […]...
- Швидкість прямолінійного рівномірного руху – Кінематика 5. Механіка 5.1. Кінематика 5.1.12. Швидкість прямолінійного рівномірного руху Прямолінійний рівномірний рух – це рух, за якого тіло (матеріальна точка) за будь-які рівні проміжки часу здійснює однакові переміщення. Швидкість прямолінійного рівномірного руху – це стала векторна фізична величина, що характеризує механічний рух і чисельно дорівнює відношенню переміщення тіла (матеріальної точки) за будь – який проміжок […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Швидкість – Кінематика 5. Механіка 5.1. Кінематика 5.1.10. Швидкість Швидкість – векторна величина, яка дорівнює відношенню переміщення точки за будь-який інтервал часу до значення цього інтервалу. Вона характеризує швидкоплинність будь-якого процесу. При рівномірному русі вона чисельно дорівнює відношенню пройденого шляху s до проміжку часу t, за який цей шлях пройдено Вектор швидкості спрямований по дотичній до траєкторії. Швидкість […]...
- ОБЧИСЛЕННЯ ШВИДКОСТІ. КУЛЯ ШВИДКІСТЬ ОБЧИСЛЕННЯ ШВИДКОСТІ. КУЛЯ 748. Запиши, яка швидкість руху: А) пішохода, якщо за 1 хв він пройшов 50 м; Б) равлика, який проповз за 1 год 3 м; В) легкової машини, яка за 1 год проїжджає 100 км; Г) горобчика, який за 2 хв пролетів 1 000 м. 749. За 5 год потяг пройшов 400 […]...
- ГРАФІКИ ШЛЯХУ І ШВИДКОСТІ Розділ ІІ Механічний рух & 14. ГРАФІКИ ШЛЯХУ І ШВИДКОСТІ Визначення шляху на графіку швидкості У фізиці й математиці використовують три способи подання інформації про зв’язок між різними величинами: а) у вигляді формули, наприклад, s =v ∙ t; б) у вигляді таблиці; в) у вигляді графіка (малюнка). Залежність швидкості від часу v(t) – графік швидкості, […]...
- Експериментальне визначення швидкості світла ФІЗИКА Частина 4 ОПТИКА. СПЕЦІАЛЬНА ТЕОРІЯ ВІДНОСНОСТІ Розділ 14 ШВИДКІСТЬ ПОШИРЕННЯ СВІТЛА. ОСНОВИ СПЕЦІАЛЬНОЇ ТЕОРІЇ ВІДНОСНОСТІ 14.1. Експериментальне визначення швидкості світла Світло, що поширюється від якогось джерела, досягає спостерігача не вмить, а через деякий час. Швидкість поширення електромагнітних хвиль дуже велика. Внаслідок цього світло проходить дуже великі відстані за надзвичайно короткі проміжки часу. Зрозуміло, що […]...
- Реакції в гетерогенному і гомогенному середовищі ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Більшість хімічних реакцій “миттєво” не відбуваються. Для реакції між початковими речовинами й утворенням продуктів потрібний певний час, який може бути дуже коротким. Запам’ятайте: реакції між Іонами відбуваються, як правило, набагато швидше, ніж реакції між молекулами. 1. Реакції в гетерогенному і гомогенному середовищі Реакції можуть відбуватися між речовинами в гетерогенному середовищі (наприклад, суміші […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ Кількість теплоти Q, яку передали системі, йде на зміну її внутрішньої енергії ΔUі на здійснення системою роботи* W проти зовнішніх сил (зовнішнього тиску р) (рис. 32): Рис. 32. Робота, яку виконує хімічна система проти зовнішнього тиску (поршень невагомий). Вуглекислий газ, який […]...
- Основні положення спеціальної теорії відносності. Швидкість світла у вакуумі як гранично допустима швидкість передавання взаємодії РЕЛЯТИВІСТСЬКА МЕХАНІКА Урок № 1 Тема. Основні положення спеціальної теорії відносності. Швидкість світла у вакуумі як гранично допустима швидкість передавання взаємодії Мета: повторити принцип відносності Галілея та ознайомити учнів із передумовами виникнення теорії відносності, сформулювати в учнів розуміння основних положень; розвивати логічне мислення, вміння аналізувати, робити висновки; формувати в учнів усвідомлення пізнаваності навколишнього світу і […]...
- Каталіз і каталізатори – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Каталіз і каталізатори Існують речовини, які здатні самою своєю присутністю в реактивній суміші змінювати швидкість хімічної реакції. Причому ці речовини в ході реакції самі не змінюються. Такі речовини називають каталізаторами, а саме явище зміни швидкості реакції в […]...
- Нерівномірний рух. Середня швидкість РОЗДІЛ I МЕХАНІЧНИЙ РУХ УРОК № 5/5 Тема уроку. Нерівномірний рух. Середня швидкість Тип уроку: засвоєння нових знань. Мета уроку: навчати розрізняти види механічного руху за зміненням швидкості тіла; формувати навички розв’язування задач; увести поняття середньої швидкості. Обладнання: кулька, похилий жолоб. План уроку Етапи Час Прийоми і методи I. Перевірка домашнього завдання 5-7 хв. Записи […]...
- Розв’язання задач на обчислення середньої швидкості 1-й семестр МЕХАНІЧНІ ЯВИЩА 1. Механічний рух Урок 6/6 Тема. Розв’язання задач на обчислення середньої швидкості Мета уроку: закріпити знання про середню швидкість; познайомити учнів з методами розв’язання задач. Тип уроку: урок закріплення знань. План уроку Контроль знань 10 хв. 1. Що розуміють під середньою швидкістю нерівномірного руху? 2. Турист годину рухався зі швидкістю 5 […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Рівноприскорений рух. Прискорення. Швидкість тіла і пройдений шлях під час рівноприскореного прямолінійного руху. Графіки руху КІНЕМАТИКА Урок № 6 Тема. Рівноприскорений рух. Прискорення. Швидкість тіла і пройдений шлях під час рівноприскореного прямолінійного руху. Графіки руху Мета: сформувати знання про рівноприскорений рух і прискорення, швидкість тіла і пройдений шлях під час рівноприскореного прямолінійного руху, графічне зображення модуля переміщення на графіку швидкості в рівноприскореному русі, умінь виводити формулу проекції переміщення; виробляти вміння […]...