ОСНОВНІ ПОЛОЖЕННЯ АТОМНО-МОЛЕКУЛЯРНОГО ВЧЕННЯ. ВЛАСТИВОСТІ ТІЛ
Розділ І Фізика як природнича наука. Методи наукового пізнання
& 4. ОСНОВНІ ПОЛОЖЕННЯ АТОМНО-МОЛЕКУЛЯРНОГО ВЧЕННЯ. ВЛАСТИВОСТІ ТІЛ
Основні положення молекулярно-кінетичної теорії (МКТ)
Багато хто з учених вважає найбільшим відкриттям в історії цивілізації доведення того факту, що речовини складаються з атомів. Результат тисячолітніх роздумів і досліджень стосовно будови речовини можна виразити одним реченням: усі тіла складаються з атомів, які неперервно та безладно рухаються і взаємодіють між собою.

Мал. 4.1. Графіт і алмаз складаються з однакових атомів

Мал. 4.2. Алмазний інструмент.
Слово “кінема” з грецької – рух. Атоми ніколи не припиняють свого руху, чим більша температура тіла, тим швидше рухаються атоми. При зменшенні температури швидкість атомів зменшується. Проте немає такої низької температури, при якій би рух атомів повністю припинився.
Друга характерна ознака – атоми рухаються безладно.
Користь від знання МКТ надзвичайна. Наприклад, відомо, що графіт і алмаз (діамант) складаються з одних і тих самих атомів Карбону (мал. 4.1), а відрізняються
Атоми і молекули.
Не всі речовини складаються з атомів одного сорту або тільки з атомів. В природі є утворення, які складаються з кількох атомів і їх називають молекулами. Мідь, наприклад, складається з атомів міді, а вода – з молекул води, які в свою чергу складаються з трьох атомів.
Молекули складаються з двох або більше атомів.
Молекули можуть складатись з атомів одного виду або з атомів різного виду. Наприклад молекула водню (Н2) складається з двох атомів Гідрогену (Н), молекула кисню – з двох атомів Оксигену (О2). А от молекула води складається з одного атома Оксигену і двох атомів Гідрогену (Н2О),молекула вуглекислого газу складається з одного атому Карбону (С) і двох атомів Оксигену (СО2мал. 4.3). Крім того, атоми скріплені в молекули у вигляді певної геометричної конструкції і це впливає на їх властивості і на властивості речовини, яка з них складається.
Молекула є найменшим носієм хімічних властивостей речовини. Якщо розкласти воду на кисень і водень, то речовини, що утворилися вже зовсім не нагадують воду – це гази кисень і водень. Атоми, в свою чергу, є найменшими носіями властивостей тих елементів, які з них складаються.
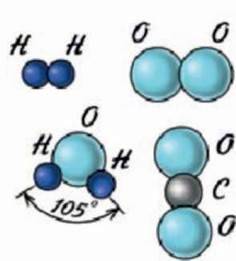
Мал. 4.3. Молекули водню, кисню, води і вуглекислого газу.
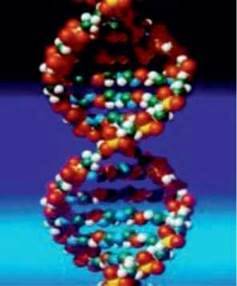
Мал. 4.4. Модель молекули ДНК.
Молекули іноді складаються с сотень тисяч атомів, наприклад ДНК – молекула, що передає спадковий код живих організмів (мал. 4.4). Усередині живої клітини молекула міститься у згорнутому стані, але якщо її вдалося б витягнути в лінію, то довжина сягнула б двох метрів.
Фізика досліджує структуру різних сполук разом з такими науками, як молекулярна біологія, фізична хімія і хімічна фізика.
Твердий, рідкий і газоподібний стани речовини
Речовина може перебувати у твердому, рідкому і газоподібному стані, які називають агрегатними станами. Охолоджуючи воду отримаємо при 0°С лід. Якщо нагрівати лід, то при 0°С він почне перетворюватися на воду (мал. 4.5). Вода, доведена до кипіння, починає перетворюватися на пару і стане газом. А якщо водяну пару привести в контакт з холодним тілом, наприклад перед носиком киплячого чайника тримати холодну ложку або тарілку, то побачимо на цих предметах крапельки води, тобто пара здійснила зворотне перетворення.
Отже у воді є щось таке, що не змінюється при її переході з рідкого стану в твердий чи газоподібний. Справа у тому, що лід, вода і водяна пара складаються з одних і тих самих молекул, хоча мають зовсім різні властивості.
Якщо розплавити сталь, то отримаємо дуже гарячу рідину. Охолоджуючи газ азот, який входить до складу повітря, до мінус 196°С, ми отримаємо прозору і дуже холодну рідину. На (рис. 4.6) показано, як киплячий рідкий азот з термоса переливають в стакан.
Кожна речовина може перебувати в трьох агрегатних станах: твердому, рідкому і газоподібному. Агрегатний стан речовини залежить від температури і від того, як сильно взаємодіють молекули.

Мал. 4.5. При кипінні вода перетворюється на пару.

Мал. 4.6. Рідкий азот кипить при -196°С.
На (рис. 4.7) схематично зображено молекули (чи атоми) твердого кристалічного тіла. Вони сильно взаємодіють між собою, коливаються біля свого місця рівноваги і утворюють правильну просторову структуру
– кристалічну решітку. У твердому і рідкому станах молекули розташовані майже впритул одна до одної. Взаємодія молекул у рідині достатньо сильна для того, щоб вони трималися разом як єдине ціле, але недостатня для підтримування форми – рідини течуть. Рідина у звичайних умовах набуває форми посудини, в якій вона знаходиться, тобто зберігає об’єм, але не має власної форми (рис. 4.8).
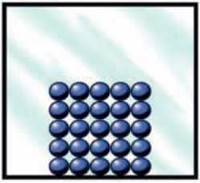
Мал. 4.7. Модель твердого стану.

Мал. 4.8. Модель рідкого стану.
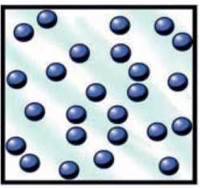
Мал. 4.9. Модель газоподібного стану.
Газ не має ані форми, ані об’єму і повністю заповнює посудину, в якій знаходиться (рис. 4.9). Відстані між молекулами газу приблизно у десять разів більші, ніж у рідкому і твердому станах, тому з одного кубічного сантиметра води можна запросто отримати один кубічний дециметр водяної пари.
Дослід 4.1
Кипіння і випаровування
А) Погляньте уважно на рис. 3.8 – на відстані декількох сантиметрів від носика чайника нічого не видно, і тільки потім з’являється те, що ми в побуті називаємо “паром”. Яка справжня природа спостережуваного явища?
Б) Чому перед кипінням в чайнику чути сильний шум, який майже вщухає, коли вода закипіла?
В) Чим, на вашу думку, відрізняється кипіння від випаровування?
Дослід 4.2 Конденсація і випаровування
А) Вийміть із холодильника і покладіть на стіл пляшку з охолодженою водою (мал. 4.10). Досить швидко поверхня пляшки запітніє, тобто покриється крапельками води. Звідки взялася ця вода?
Б) Через деякий час поверхня пляшки висохне. Куди подівалися крапельки води з поверхні?
Йони і диполі
Йон – це атом або молекула, які мають електричний заряд. Якщо атом (чи молекула) має зайві електрони, то заряд такого йона негативний, а якщо електронів не вистачає – то позитивний. Завдяки електричній взаємодії атоми і молекули у твердому стані можуть утворювати стійкі конструкції, наприклад йонну решітку, як от звичайна харчова сіль (мал. 4.11).
Диполь – це атом чи молекула, які в цілому нейтральні, але у яких позитивний і негативний заряди зміщені один відносно одного. Молекула води, внаслідок несиметричної будови (мал. 4.12), є дуже сильним диполем. Справа в тому, що атом Оксигену перетягує до себе електрони від Гідрогену і стає позитивно зарядженим. Гідроген, який втратив електрон – набуває позитивного заряду. Та сторона молекули води, в яку зміщені атоми Гідрогену має сильний позитивний заряд, а протилежна сторона, де розміщений Оксиген – негативний. Внаслідок такої будови молекул води, ця речовина має ряд унікальних властивостей. Наприклад, вода є добрим розчинником, пригадайте як легко в ній розчиняються цукор і сіль.
Дослід 4.3
Розчиніть у невеликій посудині з гарячою водою стільки солі, щоб вона вже перестала розчинятися. Потім дайте розчину схолонути і опустіть туди нитку чи гілочку. Почекайте, поки вода випарується (це може зайняти від кількох днів до тижня) і вийміть нитку чи гілку. Опишіть дослід і спробуйте його пояснити.
Підведемо підсумки
– Атоми і молекули перебувають в постійному безладному русі і взаємодіють між собою.
– В залежності від сили взаємодії між атомами (чи молекулами), речовина може перебувати в твердому, рідкому чи газоподібному стані.
– МКТ дозволяє фізикам і хімікам створювати штучні матеріали з унікальними властивостями і використовувати їх у виробництві, науці, техніці та побуті.
– Хімічні елементи складаються з атомів одного виду. Прості речовини складаються з атомів одного виду, або молекул, що складаються з атомів одного виду.
Творчі завдання
4.1. Чому графіт потрібно не тільки сильно стиснути, а ще й дуже нагріти, щоб перетворити його на алмаз?
4.2. Поясніть механізм розчинення солі чи цукру у воді.
4.3. Яка структура фулеренів С60, карбонових нанотрубок і графене?
Вправа 4
1. Від чого залежить швидкість руху молекул і атомів?
2. Чим відрізняється молекула від атома?
3. Скільки атомів містить молекула вуглекислого газу?
4. Як прочитати абревіатуру МКТ, і яка вигода від знання цієї теорії?
5. Які найменші частинки є носіями хімічних властивостей а) елементів, б) речовини?
6. Чи змінюються молекули води при переході в твердий чи газоподібний стан?
7. Які науки крім фізики вивчають будову речовини?
8. Графіт і алмаз: що у них спільного і чим вони відрізняються?
9. Намалюйте молекулу водню, зобразивши атоми у вигляді кружечків.
10. Зобразіть схематично молекули води, кисню і вуглекислого газу.
11. Чим відрізняються молекули різних речовин між собою?
12. Що спільного і які відмінності в будові молекул води і вуглекислого газу?
13. Які атоми і в якій кількості містить молекула C2H5OH?
14. Чому вода є хорошим розчинником?
15. В якому стані знаходиться речовина, якщо її молекули мають порядок у розташуванні і сильно взаємодіють між собою?
16. Як змінюється відстань між молекулами води при випаровуванні?
17. В якому агрегатному стані знаходяться а) вода, б) лід, в) водяна пара, г) туман?
19. Чому рідкий азот, коли його наливають в стакан (рис. 4.3), так сильно парує?
18. Доведіть, що якщо бути точним, то молекула води складається з йонів Гідрогену та Оксигену
20. Чи можете ви навести приклад із вашого досвіду, який свідчить про існування проміжків між атомами та молекулами?
21. Чому цукор розчиняється в гарячій воді швидше, ніж в холодній?
22. В яких випадках вода може зберігати не тільки об’єм, а й форму?
23. Чому водяну пару (тобто газ) не видно, а туман можна бачити?
