Особливості будови атома Карбону в основному та збудженому станах. Утворення ковалентного зв’язку між атомами Карбону. Структурні формули органічних речовин
Тема 3
НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ
Урок 32
Тема уроку. Особливості будови атома Карбону в основному та збудженому станах. Утворення ковалентного зв’язку між атомами Карбону.
Структурні формули органічних речовин
Цілі уроку: розширити знання учнів про взаємозв’язок складу, будови та властивостей речовин, про хімічний зв’язок на прикладі органічних сполук; ознайомити учнів з теорією хімічної будови О. м. Бутлерова; формувати уявлення учнів про структурні формули органічних речовин.
Тип уроку: комбінований
Форми роботи: фронтальна робота, розповідь учителя, евристична бесіда.
Обладнання: кристалічні гратки алмаза, графіту, моделі молекул органічних речовин.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання.
Актуалізація опорних знань
Фронтальна робота за питаннями
– Чому органічну хімію називають хімією сполук Карбону?
– Складіть схему будови атома Карбону.
– Назвіть можливі валентності та ступені окиснення атома Карбону.
– Чому атоми Карбону можуть утворювати хімічні зв’язки
Розглянемо будову зовнішнього електронного рівня атома Карбону.

– Який тип зв’язку називається ковалентним?
Розглянемо кристалічні гратки алмаза й графіту.
– Чим відрізняються кристалічні гратки алмаза й графіту?
– Які хімічні елементи, крім Карбону, найчастіше перебувають у складі органічних сполук?
ІІІ. Вивчення нового матеріалу. Теорія хімічної будови О. М. Бутлерова
Розповідь учителя
Багато вчених-хіміків вивчали органічні речовини. Але головною метою був пошук шляхів синтезу нових речовин. Для цього була необхідна теорія, що дозволила б пояснити вже відомі факти й нові відкриття. Такою теорією в органічній хімії є теорія хімічної будови, основні положення якої сформулював у своїх наукових працях О. м. Бутлеров.
19 вересня 1861 року на з’їзді німецьких натуралістів і лікарів О. М. Бутлеров доповідав про нові теорії в органічній хімії. Він висунув нове поняття – “структура”, що відбивало послідовність будови атомів у молекулі. Так народилася структурна теорія, або теорія хімічної будови.
У різних джерелах називають різну кількість положень теорії хімічної будови. Наведемо основні:
1. У молекулах речовин існує чітка послідовність хімічного з’єднання атомів відповідно до їх валентності, що називається хімічною структурою (будовою).
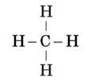
Для зображення послідовності з’єднання атомів у молекулі Бутлеров запропонував використати валентні штрихи (риски) між атомами. Так, з урахуванням того, що в органічних сполуках атом Карбону завжди чотиривалентний, а Гідроген одновалентний, можна записати формулу найпростішої органічної сполуки, причому така формула може бути лише одна:
– молекулярна формула: CH4 (метан);
– структурна формула:
2. Хімічні властивості речовин визначаються природою елементарних складових, їх кількістю й порядком з’єднання (хімічною будовою).
Тобто хімічні властивості речовини залежать не лише від того, які атоми входять до складу речовини (що відбиває молекулярна формула), а й від того, у якій послідовності ці атоми з’єднані один з одним (що відбиває структурна формула).
3. Існування речовин з однаковим складом і молекулярною масою, але різною будовою, зумовлене явищем ізомерії.
Ізомерія – явище, за якого можуть існувати кілька речовин, що мають той самий склад і ту саму молекулярну масу, але відрізняються хімічною будовою і властивостями.
Речовини, що мають однаковий склад молекул, але різну хімічну будову, і тому мають різні властивості, називаються ізомерами. Наприклад: C4H10 – 2 ізомери, С10Н22 – 74 ізомери, C14H30 – 1 858 ізомерів.
4. Оскільки в конкретних реакціях змінюються лише деякі частини молекули, то дослідження будови продукту реакції допомагає визначити будову вихідної молекули.
5. Хімічна природа (реакційна здатність) окремих атомів молекули змінюється залежно від оточення, тобто від того, з якими атомами інших елементів вони з’єднані.
Теорія хімічної будови, основні положення якої були сформульовані в роботах російського вченого-хіміка О. М. Бутлерова, дає принципову можливість визначення геометрії молекули через з’ясування хімічних властивостей. Структурні формули в руках хіміків стали потужною зброєю. Вони дають можливість робити висновки про хімічні властивості сполук, систематизувати величезний матеріал органічної хімії, передбачати існування незліченної кількості нових сполук і знаходити шляхи їх синтезу.
IV. Підбиття підсумків уроку
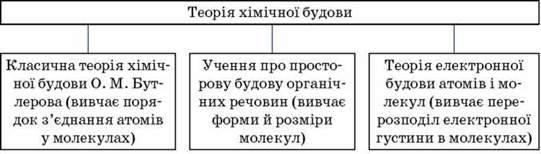
Розвиток сучасної теорії хімічної будови
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
