Поняття про колоїдні розчини – ПІДГРУПА КАРБОНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 11. ПІДГРУПА КАРБОНУ
§ 11.7. Поняття про колоїдні розчини
У природі і техніці часто трапляються дисперсні системи, в яких одна речовина рівномірно розподілена у вигляді частинок всередині іншої речовини.
В дисперсних системах розрізняють дисперсну фазу – тонко подрібнену речовину і дисперсійне середовище – однорідну речовину, в якій розподілена дисперсна фаза. Наприклад, у каламутній воді, що містить глину, дисперсною фазою
До дисперсних систем належать звичайні (істинні) розчини, колоїдні розчини, а також суспензії та емульсії. Вони відрізняються один від одного насамперед розмірами частинок, тобто ступенем дисперсності (подрібненості).
Системи з розміром частинок, меншим за 1 нм, являють собою істинні розчини,
Суспензії – це дисперсні системи, в яких дисперсною фазою є тверда речовина, а дисперсійним середовищем – рідина, причому тверда речовина практично нерозчинна в рідині. Щоб приготувати суспензію, треба речовину подрібнити до тонкого порошку, висипати в рідину, в якій речовина не розчиняється, і добре збовтати (наприклад, збовтування глини у воді). Через деякий час частинки випадуть на дно посудини. Очевидно, чим дрібніші частинки, тим довше зберігатиметься суспензія.
Емульсії – це дисперсні системи, в яких і дисперсна фаза, і дисперсійне середовище є рідинами, що не змішуються між собою. З води та олії можна приготувати емульсію, довго збовтуючи суміш. Прикладом емульсії є молоко, в якому дрібні кульки жиру плавають у рідині.
Суспензії та емульсії – двофазні системи.
Колоїдні розчини – це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої перебувають в межах від 1 до 100 нм. Як бачимо, колоїдні розчини за розмірами частинок є проміжними між істинними розчинами та суспензіями і емульсіями. Колоїдні частинки звичайно складаються з великої кількості молекул або іонів.
Колоїдні розчини інакше називають золями. їх добувають дисперсійними та конденсаційними методами. Диспергування найчастіше здійснюють за допомогою особливих “колоїдних млинів”. При конденсаційному методі колоїдні частинки утворюються за рахунок об’єднання атомів або молекул в агрегати. Наприклад, якщо збуджувати у воді дуговий електричний розряд між двома дротиками із срібла, то пара металу конденсується в колоїдні частинки. Під час перебігу багатьох хімічних реакцій також відбувається конденсація і утворюються високодисперсні системи (випадання осадів, перебіг гідролізу, окисно-відновні реакції тощо).
Золі мають ряд специфічних властивостей, які детально вивчає колоїдна хімія. Так, золі залежно від розмірів частинок можуть мати різне забарвлення, а в істинних розчинів воно однакове. Наприклад, золі золота можуть бути синіми, фіолетовими, вишневими, рубіново-червоними.
На відміну від істинних розчинів для золів характерний ефект Тіндаля, тобто розсіювання світла колоїдними частинками. Під час пропускання крізь золь пучка світла з’являється світлий конус, видимий у затемненому приміщенні (рис. 11.3). Таким
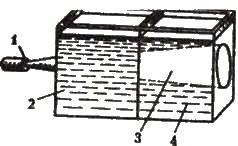
Рис. 11.3. Проходження променя крізь істинний і колоїдний розчини:
1 – джерело світла; 2 – істинний розчин;
3 – світловий конус; 4 – колоїдний розчин (золь)
Чином можна розпізнати, колоїдним чи істинним є даний розчин.
Однією з важливих властивостей золів є те, що частинки даного золю мають електричні заряди одного знака. Завдяки цьому вони не об’єднуються в більші частинки і не осаджуються. При цьому частинки одних золів, наприклад металів, сульфідів, силікатної та станатної кислот, мають негативний заряд, інших, наприклад гідроксидів, оксидів металів,- позитивний заряд. Виникнення заряду пояснюється адсорбцією колоїдними частинками іонів з розчину.
Для осадження золю необхідно, щоб його частинки об’єдналися в більші агрегати. Об’єднання частинок в більші агрегати називається коагуляцією, а осадження їх під дією сили гравітації – седиментацією.
Звичайно коагуляція відбувається при додаванні до золю:
1) електроліту; 2) іншого золю, частинки якого мають протилежний заряд; 3) при нагріванні.
За певних умов коагуляція золів призводить до утворення драглистої маси, яку називають гелем. У цьому разі вся маса колоїдних частинок, зв’язуючи розчинник, переходить у своєрідний напіврідкий-напівтвердий стан. Від гелів слід відрізняти драглі – розчини високомолекулярних речовин у низькомолекулярних рідинах (системи гомогенні). Вони можуть утворитися при набуханні твердих полімерів у певних рідинах.
Значення золів винятково велике, оскільки вони поширеніші, ніж істинні розчини. Протоплазма живих клітин, кров, соки рослин – все це складні золі. Із золями пов’язано виробництво штучних волокон, чинення шкір, фарбування, виготовлення клеїв, лаків, плівок, чорнила. Багато золів у грунті, і вони мають важливе значення для його родючості. Силікагель, тобто зневоднена силікатна кислота, широко використовується при очищенні рідин і газів.
