Приклади розв’язування типових задач – Урок 3
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
Приклади розв’язування типових задач
Задача 1. Укажіть кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду.
Розв’язання
Сl2O. Будова електронних оболонок елементів Хлору і Оксигену:

З формули видно, що Хлор перебуває в основному (незбудженому) стані та виявляє валентність І. При утворенні молекули оксиду відбувається перекриття р-орбіталей
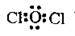
Отже, кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду, дорівнює чотирьом.
Задача 2. Укажіть кількість електронів, які беруть участь в утворенні хімічних зв’язків у молекулі 1,2-дихлоретену.
Розв’язання
Структурна формула речовини:
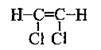
З формули видно, що у молекулі є 6 спільних пар електронів. Отже, кількість електронів, які утворюють хімічні зв’язки у молекулі 1,2-дихлоретену, дорівнює 12.
Задача 3. Укажіть неметалічні елементи, між атомами яких утворення
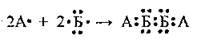
Розв’язання
Елемент А у зовнішньому електронному шарі містить лише 1 електрон – це Гідроген. Елемент Б у зовнішньому електронному шарі містить 6 електронів – це Оксиген. Отже, це речовина гідроген пероксид.
Задача 4. Укажіть тип зв’язку для речовини, які утворена елементами з порядковими номерами 20 і 9.
Розв’язання
Елемент з порядковим номером 20 – Кальцій – типовий металічний елемент, лужноземельний. Елемент з порядковим номером 9 – Флуор – типовий неметалічний елемент, галоген. При їх сполученні утворюється речовина з іонним типом зв’язку.
Задача 5. Елемент А з конфігурацією зовнішнього електронного шару 2s22р4 утворює ковалентну сполуку з Гідрогеном і елементом Б з конфігурацією зовнішнього електронного шару 2s22р2 у його збудженому стані. Складіть електронну формулу сполуки та вкажіть загальну кількість електронів, які взяли участь в утворенні зв’язків.
Розв’язання
Елемент А 2s22р4 – Нітроген, елемент Б 2s22р2 – Карбон. Електронна оболонка Карбону у збудженому стані – 2s12р3. Електронна формула сполуки, яка утворилась:
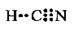
В утворенні зв’язку взяло участь 8 електронів.
Задача 6. Із запропонованого ряду формул речовин: СО2, SО2, SiО2, LiOH, HF, CuO, C3H8, C6H12О6 виберіть такі, що мають молекулярні кристалічні гратки. Укажіть суму молярних мас цих речовин.
Розв’язання
Молекулярні кристалічні гратки серед наведеного ряду речовин мають:
– карбон(ІV) оксид, СO2 – газ (за н. у.), М(СO2) = 44 г/моль;
– сульфур(ІV) оксид, SO2 – газ, M(SO2) = 64 г/моль;
– пропан, С3Н8 – газ, М(С3Н8) = 44 г/моль;
– глюкоза, С6Н12O6 – тверда речовина, М(С6Н12О6) = 180 г/моль.
Сума їхніх молярних мас становить 332 г/моль.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Приклади розв’язування типових задач – Урок 2 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома Приклади розв’язування типових задач Задача 1. Укажіть протонне число елемента, в атомі якого міститься на 4 електрони менше, ніж у йоні Аl3+. Розв’язання Іон Аl3+ утворюється в результаті віддачі атомом Алюмінію трьох електронів: Елемент E має (10 – 4 =) […]...
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...
- Приклади розв’язування типових задач – Урок 8 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води. Дано: Розв’язання 1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), […]...
- Визначення середньої молярної маси суміші газів – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач V. Визначення середньої молярної маси суміші газів Формули і поняття, які використовуються: Де М(суміші) – середня молярна маса суміші газів, М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, Χ(А), χ(Б), […]...
- Приклади розв’язування типових задач – Урок 7 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Складіть молекулярне рівняння, що відповідає такому скороченому йонно-молекулярному рівнянню: Розв’язання Йонно-молекулярне рівняння реакції показує, що під час реакції відбулось зв’язування йонів Купруму Сu2+ і сульфід-іонів S2- в нерозчинну сполуку купрум(ІІ) сульфід CuS, тобто […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Приклади розв’язування типових задач – Урок 6 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині. Дано: Розв’язання Відповідь: w(NaCl) = 6,25 %. Задача 2. Натрій гідроксид, маса якого 10 […]...
- Обчислення відносної густини газу – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач III. Обчислення відносної густини газу Формули і поняття, які використовуються: Де Dnов.(X) – відносна густина газу X за повітрям, DA(X) – відносна густина газу X за газом А, М(Х) – молярна маса газу X, […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Приклади розв’язування типових задач – Урок 4 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Визначте ступені окиснення Фосфору в таких сполуках: К3Р, Na3PO4, К4Р2O7, Р2O5, Н3РO3. Розв’язання Задача 2. Визначте ступені окиснення Сульфуру в сполуках Na2SO3, Al2(SO4)3, Na2S2O3, SO2, SO3. Розв’язання Al2(SO4)3. Для встановлення ступеня окиснення Сульфуру можна […]...
- Виведення формули сполуки – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач VI. Виведення формули сполуки Зауважимо, що співвідношення значень індексів у формулі речовини дорівнює співвідношенню кількості атомів елементів у сполуці та відповідно співвідношенню кількостей речовини елементів. Отже, для речовини, формула якої Р2O5, можна записати: Якщо […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач Суть розв’язування задач цього типу полягає в розстановці коефіцієнтів і перетворенні схем реакцій на рівняння. Задача 1. Схема реакції: Ставимо коефіцієнт 4 перед формулами NH3 і NO, а коефіцієнт 5 – перед формулою O2: Залишається дібрати […]...
- Приклади розв’язування типових задач – Урок 9 – Основні класи неорганічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 7. Основні класи неорганічних сполук Приклади розв’язування типових задач Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: Розв’язання 1. Для одержання магній оксиду магній потрібно спалити в кисні: 2. Магній оксид – це основний оксид, а тому реагує з […]...
- Обчислення масової частки елемента в сполуці – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач II. Обчислення масової частки елемента в сполуці Формули і поняття, які використовуються: Де w(E) – масова частка елемента Е в сполуці, Аr(Е) – відносна атомна маса елемента Е, N(E) – кількість частинок (атомів, іонів) […]...
- Розв’язування типових задач – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ §11.10. Розв’язування типових задач Задача 1. Під час прожарювання кристалогідрату CuSO4 ∙ 5Н2O масою 10,0 г відбулося часткове видалення води. Визначте формулу добутого кристалогідрату, якщо його маса дорівнює 7,84 г. Розв’язання. Складаємо рівняння реакції: CuSO4 ∙5Н2О = CuSO4 […]...
- Тести – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Тести 3.1 Укажіть тип хімічного зв’язку в речовині, формула якої NaF А йонний Б ковалентний неполярний В ковалентний полярний Г металічний 3.2 Укажіть формулу речовини з полярним ковалентним зв’язком А КВr Б KF B N2 Г Н2O 3.3 Укажіть тип […]...
- Приклади розв’язування типових задач з геометрії для найпростіших фігур Геометрія Приклади розв’язування типових задач з геометрії для найпростіших фігур Треба добре розуміти: коли ми доводимо теорему або розв’язуємо задачу, кожне твердження треба обгрунтувати, тобто показати, що воно випливає з якої-небудь аксіоми чи раніше доведеної теореми. Якщо ви спираєтеся на якусь теорему, ретельно перевірте, чи повністю виконано її умову. Наприклад, при застосуванні першої ознаки рівності […]...
- Розв”язання типових задач ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.12 Розв”язання типових задач Періодичний закон Д. І. Менделєєва, ізотопи Задача 1. В якій групі і якому періоді періодичної системи елементів Д. І. Менделєєва перебуває елемент з порядковим номером 42? Розв’язання. […]...
- Розв’язування типових задач – АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 18. АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 18.7. Розв’язування типових задач Задача 1. Як можна добути анілін, виходячи з метану і не використовуючи інші органічні сполуки? Зазначте умови перебігу реакцій. Розв’язання. Проводячи піроліз метану, можна добути ацетилен: T 2СН4 -> С2Н2 + ЗН2. […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.14. Розв’язування типових задач Масова частка розчиненої речовини Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину. Розв’язання. Обчислюємо […]...
- Розв’язування типових задач – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 17.19. Розв’язування типових задач Задача 1. Етанол об’ємом 30 мл (густина 0,79 г/мл) нагріли з надлишком броміду натрію і сульфатної кислоти. З реакційної суміші виділили брометан масою 42,3 г. Обчисліть масову частку виходу брометану. Розв’язання. При […]...
- Тести – Урок 2 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома Тести 2.1 Укажіть рядок, що містить назви лише s-елементів А Натрій, Неон, Хлор Б Бром, Хлор, Гелій В Гідроген, Кальцій, Алюміній Г Гелій, Гідроген, Магній 2.2 Укажіть протонне число елемента, електронна формула якого…3s23p6 А 17 Б 16 В 18 Г […]...
- Тести – Урок 4 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Тести 4.1 Установіть відповідність реагентів з типом реакції, що між ними відбувається Реагенти: Тип реакції: 1 магній оксид і нітратна кислота А сполучення 2 магній і хлор Б заміщення 3 магній і хлоридна кислота В обмін 4 магній нітрид і […]...
- Розв’язування задач за допомогою рівнянь – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Розв’язування задач за допомогою рівнянь Для розв’язування таких задач зручно користуватися таблицями. Задача 1. В одній шафі було в 6 разів більше книг, ніж у другій. Після того як із однієї шафи взяли 46 книг, а з другої – 18 книг, у першій шафі залишилося на 97 книг […]...
- Задачі на відсотки – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на відсотки Задачі на відсотки – це задачі на пряму пропорційність. Задача 1. Зі свіжих слив виходить 21% сушених. Скільки сушених слив можна отримати із 75 кг свіжих? Розв’язання Запишемо умову: Складемо пропорцію: . Звідси . Відповідь: 15,75 кг. Задача 2. Перший тракторист зорав 40% поля, другий […]...
- Задачі на знаходження числа за даним значенням його дробу – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на знаходження числа за даним значенням його дробу Задача 1. Для класу купили зошити, ручки та олівці. Вартість зошитів становила вартості всієї покупки, вартість ручок – , а вартість олівців – 70 гривень, що залишились. Знайти вартість покупки. Розв’язання 1) – таку частину вартості всієї покупки становить […]...
- Задачі на дроби – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на дроби 1. Щоб знайти дроб від числа, треба це число поділити на знаменник і одержане число помножити на чисельник дробу. Задача. У бочці було 60 л води. Відлили усієї води. Скільки води залишилось? Розв’язання I спосіб: 1) (л) води відлили; 2) (л) залишилось. II спосіб: 1) […]...
- Комбінаторні задачі – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Комбінаторні задачі Задача 1. Запишіть усі трицифрові числа, що складаються із цифр 3, 4, 7, причому в записі цих чисел кожна цифра має використовуватися один раз. Розв’язання І спосіб Першу цифру в числі можна обрати трьома способами, цифру, яка стоїть на другому місці,- двома способами; на третьому місці […]...
- Розв’язування типових задач – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.9. Розв’язування типових задач Окисно-відновні реакції Задача 1. Доберіть коефіцієнти у схемі окисно-відновної реакції: S + HNO3 −> H2SO4 + NO. Розв’язання. Коефіцієнти знаходимо методом електронного балансу. Зазначимо ступені окиснення елементів, які їх змінюють: 0 +5 […]...
- Задачі на рух – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на рух Задача. Відстань від А до В дорівнює 120 км. Відстань від А до В автомобіль проїхав зі швидкістю 40 км/год, а від В до А – зі швидкістю 60 км/год. Яка середня швидкість його руху? Розв’язання Щоб знайти середню швидкість автомобіля, треба весь шлях поділити […]...
- Задачі на пропорційне ділення – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на пропорційне ділення Задача 1. Розчин містить 7 частин цукру й 11 частин води. Скільки цукру потрібно взяти, щоб одержати 549 г розчину? Розв’язання Нехай маса однієї частини х г. Тоді маса цукру 7х г, а води – 11х г. За умовою задачі, маса розчину г, або […]...
- Задачі на пряму та обернену пропорційність – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на пряму та обернену пропорційність Задача 1. На пошиття 20 костюмів витратили 83 м тканини. Скільки таких самих костюмів вийде з 58,1 м тканини? Розв’язання Запишемо умову задачі у вигляді: Залежність між витраченою тканиною й кількістю костюмів – пряма пропорційність. (Тобто у скільки разів більше костюмів, у […]...
- Розв’язування типових задач ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.8. Розв’язування типових задач Задача 1. Реакція за температури 50° С відбувається за 2 хв 15 с. За який час закінчиться ця реакція за температури 70°С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює З? […]...
- Розв’язування типових задач Оксиди, кислоти, основи, солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.7. Розв’язування типових задач Оксиди, кислоти, основи, солі Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення; CuSO4 -> Сu -> СuО -> СuСl2 -> Сu(OН)2 -> Cu(OH)NO3 -> Сu(NO3)2. Розв’язання. 1) […]...
- Задачі на знаходження частини від числа – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на знаходження частини від числа Задача 1. За три дні учень прочитав книгу в 240 сторінок. За перший день він прочитав книги, за другий – книги, а за третій – усе, що залишилось. Скільки сторінок прочитав учень за третій день? Розв’язання I спосіб 1) (с.) учень прочитав […]...
- Задачі на рівняння – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на рівняння Задача. Група туристів за три дні пройшла 74 км. За перший день туристи пройшли на 8,5 км менше, ніж за другий, а за третій стільки, скільки за другий. Який шлях проходили туристи кожного дня? Розв’язання Усі три величини невідомі, але в умові задачі зазначаються співвідношення […]...
- Задачі на спільну роботу – Приклади розв’язування типових завдань Математика – Алгебра Приклади розв’язування типових завдань Задачі на спільну роботу У розв’язанні цих задач велику роль відіграють такі величини: частина всієї роботи, яку виконує робітник (бригада, машина) за одиницю часу; час, який було витрачено на роботу; частина роботи, яку було виконано. Задача. Одна бригада може виконати певну роботу за 10 днів, друга – за […]...