Промисловий синтез амоніаку
РОЗДІЛ 4 ПРОМИСЛОВЕ ВИРОБНИЦТВО НАЙВАЖЛИВІШИХ НЕОРГАНІЧНИХ РЕЧОВИН
§ 73. Промисловий синтез амоніаку
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати хіміко-технологічну схему синтезу амоніаку, будову й роботу колони синтезу; складати рівняння синтезу амоніаку; характеризувати технологічну схему виробництва; обгрунтовувати оптимальні умови синтезу;
Описувати становлення виробництва синтетичного амоніаку в Україні.
У промисловості амоніак синтезують з простих речовин – азоту N2 і водню Н2:
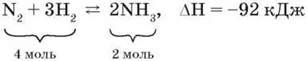
За яких умов здійснюється цей синтез, можна дізнатися з рівняння реакції. 0днак для виробництва цього замало, бо основним завданням є не просто добування амоніаку, а добування найбільш економічним способом. Для цього необхідно з’ясувати оптимальні умови синтезу, тобто як досягти найбільшого виходу амоніаку, а процес – пришвидшити.
Звернімося до рівняння реакції. Що з нього видно?
1. Ця реакція є оборотною, отже, до кінця не відбувається, у процесі реакції встановлюється хімічна рівновага.
2. Реакція відбувається між газами зі зменшенням об’єму.
3. Реакція екзотермічна, її перебіг
Як саме керувати такою реакцією, пам’ятаючи, що виробництво амоніаку має бути економічно вигідним?
Пригадаємо теорію, а саме – принцип Ле Шательє: якщо система перебуває в стані рівноваги, то в процесі дії на неї сил, що викликають зсув рівноваги, система переходить у такий стан, в якому ефект від цього впливу послаблюється.
Тож розмірковуємо: якщо реакція екзотермічна, то потрібно знизити температуру, щоб амоніак не розкладався. Oднак зі зниженням температури швидкість реакції уповільнюється, тому доцільно використати каталізатор. Проте відомо, що каталізатор починає активно діяти лише при нагріванні до певної температури. Oтже, знижувати температуру можна, але до певної межі.
Далі звертаємо увагу на те, що реакція між газами відбувається зі зменшенням об’єму. Це означає, що рівновага зміщуватиметься в бік утворення амоніаку за умови підвищеного тиску. Проте навіть за дуже високого тиску зв’язати весь азот і водень неможливо, а застосування високих тисків позначиться на вартості обладнання і затратах енергії при стисненні газової суміші.
Виходячи з умов процесу, робимо висновок, що для синтезу амоніаку необхідно:
А) застосувати невеликий тиск (30 МПа), що дає змогу змістити рівновагу в бік утворення амоніаку;
Б) використати каталізатор (губчасте залізо з домішками Al2O3 і К2Щ);
В) підвищити температуру (до 450 – 550 °С).
Такі умови є оптимальними для економічно вигідного синтезу амоніаку.
Реакція відбувається в колоні синтезу (мал. 135). Вона складається з теплообмінника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутрішній діаметр корпусу колони. 0тже, між каталізаторною коробкою і корпусом утворюється щілина. Холодна суміш азоту з воднем надходить у колону крізь цю щілину і запобігає перегріванню корпусу. Газова суміш іде донизу, проходить між гарячими трубками теплообмінника, нагрівається і потрапляє до коробки каталізатора. Саме тут, на каталізаторі, відбувається синтез амоніаку. При цьому виділяється багато теплоти. Гаряча суміш амоніаку, азоту й водню надходить у трубки теплообмінника, нагріваючи їх. Відбувається теплообмін, теплота реакції утилізується – це один з важливих принципів сучасного виробництва.
Газ, що виходить з колони синтезу, містить 12-15 % амоніаку. Тоді незрозуміло, чому синтез вважається економічно вигідним. Річ у тому, що надалі в процесі виробництва використовують принцип циркуляції, за яким азот і водень, що не прореагували, відокремлюються від зрідженого амоніаку і знову повертаються в колону синтезу. Завдяки принципу циркуляції на сучасних заводах вихід амоніаку становить 96 – 98 %.
В Україні перший завод з виробництва синтетичного амоніаку став до ладу в 1933 р. у м. Горлівці Донецької області. Пізніше з’явилися заводи в Дніпродзержинську (1938), Сєверодонецьку (1958), Черкасах (1962), Рівному (1965). Нині тривають дослідження щодо вдосконалення технології аміачного виробництва.
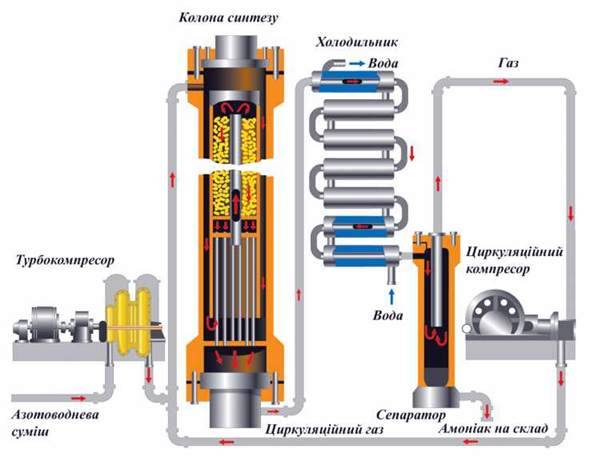
Мал. 135. Промисловий синтез амоніаку
Коротко про головне
Сировиною для синтезу амоніаку є азот і водень, їх взаємодія відбувається в колоні синтезу. Оптимальні умови синтезу – тиск 30 МПа, наявність каталізатора, температура 450 – 550 °С.
Серед основних наукових принципів, на яких грунтується промисловий синтез амоніаку, – безперервність процесу, циркуляція, теплообмін тощо.
