Проведення титрування – Титрування кислот і основ – Нейтралізація
КИСЛОТИ Й ОСНОВИ
3. Нейтралізація
3.2. Титрування кислот і основ
Проведення титрування
Для визначення концентрації кислоти або лугу потрібне таке приладдя:
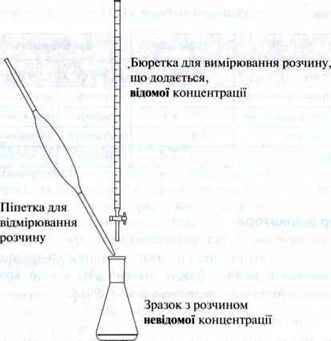
– піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації;
– бюретка для вимірювання розчину відомої концентрації;
– Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації.
Після додавання відповідного індикатора для титрування
Приклад. Етанову кислоту з невідомою концентрацією титрують 0,1-М-розчином їдкого натру в присутності фенолфталеїну як індикатора.
Відомі величини:
– концентрація розчину їдкого натру (лугу): сЛ = 0,1 моль/л;
– використаний об’єм розчину їдкого натру: VЛ = 25 мл;
– відміряний об’єм етанової кислоти: VK = 10 мл.
Розрахунок концентрації ск:
– витрачена хімічна кількість їдкого натру в розчині:
NЛ = сл ∙ VЛ = 0,1 моль/л
Оскільки в розчині їдкий натр продисоціював повністю, то ця хімічна кількість відповідає використаній хімічній кількості гідроксид-іонів. Вони у свою чергу вступають у реакцію з такою самою хімічною кількістю іонів гідроксонію, які утворюються з такої ж хімічної кількості етанової кислоти. Тому:
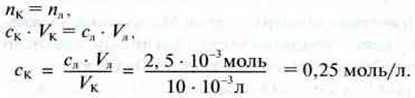
Використовуючи молярну масу етанової кислоти, можна розрахувати також масову концентрацію – титр (Т):
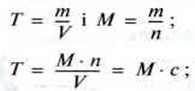
М (етанова кислота) = 60 г/моль;
Т = 60 г/моль ∙ 0,25 моль/л = 15 г/л.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Індикатори – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Титрування – це кількісний спосіб визначення невідомої концентрації розчину. При титруванні методом нейтралізації шукана концентрація кислоти визначається за допомогою лугу відомої концентрації. Індикатори Для визначення точки еквівалентності необхідний кислотно-основний індикатор. Такий індикатор є найчастіше слабкою кислотою, яка має інше забарвлення, відмінне від відповідної зв’язаної основи. […]...
- Вибір індикатора – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Вибір індикатора Для визначення точки еквівалентності при титруванні потрібно мати відповідний індикатор, зміна кольору якого відбувається в межах області значень pH, в якій крива титрування проходить вертикально. Запам’ятайте: – Крива титрування сильних лугів сильними кислотами має велику (область значень pH по вертикалі. Для визначення точки […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Проба розчином Фелінга – Виявлення альдегідів АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 2 . Визначення властивостей речовин 2.2. Виявлення альдегідів Альдегіди в лужному розчині є сильними відновниками. При цьому карбонільна група окислюється в карбоксильну групу. Відновлення відповідних іонів металів є доказом наявності альдегідів. Проба розчином Фелінга Як реагент використовують розчин купрум(ІІ) сульфату. Іони Си(ІІ), що містяться в ньому, вступають у реакцію в лужному розчині […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Теорія Бренстеда – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.2. Теорія Бренстеда Багато речовин утворюють кислі або лужні розчини, але не відповідають наведеним визначенням кислот і лугів. Приклад. Розчин амоній хлориду має кислу реакцію, а розчин натрій ацетату – лужну. У зв’язку з цим Йоганн Бренстед і Томас Лоурі сформулювали в 1923 р. нове визначення кислот […]...
- Чисельне вираження складу розчинів – РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.1. Чисельне вираження складу розчинів У природі й техніці розчини мають величезне значення. Рослини засвоюють речовини у вигляді розчинів. Засвоєння їжі пов’язане з переходом поживних речовин у розчин. Усі природні води є розчинами. Розчинами є […]...
- Загальні способи одержання оксидів, основ, кислот, солей Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 34 Тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук. Тип […]...
- Значення pH буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Суміш слабкої кислоти і зв’язаної основи, або слабкої основи і її зв’язаної кислоти характеризується тим, що її водневий показник при додаванні не дуже великої кількості іонів гідроксонію або гідроксид-іонів практично не змінюється. Розчини, показник pH яких по відношенню до кислот і лугів залишається стабільним, називають буферними […]...
- Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.7. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації Згідно з теорією електролітичної дисоціації, кислоти – це сполуки, які дисоціюють на катіони Гідрогену1 та аніони кислотного залишку: Як уже згадувалось, багатоосновні кислоти дисоціюють ступінчасто. Основність кислоти визначається […]...
- Розвиток понять “кислоти” й “основи” – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості: – кислий смак; – розчиняють неблагородні метали, виділяючи водень; – розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду; – змінюють забарвлення індикаторів. До основ відносяться речовини, водні розчини яких (луги) мають такі властивості: – мильні на дотик; […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Добуток розчинності – Рівновага розчинності ХІМІЧНА РІВНОВАГА 3. Рівновага розчинності 3.2 . Добуток розчинності Якщо до насиченого розчину солі у воді ще додати цю ж сіль, то ця добавка випаде в нерозчинений осад. Якщо до нього додати сіль, що містить один з іонів розчиненої солі, то утвориться такий самий осад. Приклад. Якщо до насиченого розчину кальцій сульфату додати трохи кальцій […]...
- СПОСОБИ ВИРАЖЕННЯ КІЛЬКІСНОГО СКЛАДУ РОЗЧИНУ – ВОДА. ВОДНІ РОЗЧИНИ Хімія – універсальний довідник ВОДА. ВОДНІ РОЗЧИНИ СПОСОБИ ВИРАЖЕННЯ КІЛЬКІСНОГО СКЛАДУ РОЗЧИНУ Розчини – речовини змінного складу. Природно, що від кількісного складу розчину залежать його властивості, тому при описі властивостей розчину необхідно вказувати його склад. Склад розчину характеризують відносним вмістом у ньому розчиненої речовини. Прийнято виражати склад розчинів через частки або концентрації. Частка показує відношення […]...
- Виявлення лугів і кислот у розчинах за допомогою індикаторів Розділ 3 Вода 29 Виявлення лугів і кислот у розчинах за допомогою індикаторів Матеріал параграфа допоможе вам: > з’ясувати, які речовини називають індикаторами; > навчитися виявляти луги і кислоти в розчинах за допомогою індикаторів. Розчини лугів і кислот здатні змінювати забарвлення особливих речовин – індикаторів1. Ці речовини було спершу виявлено в плодах і квітках рослин, […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Властивості мила й інших поверхнево-активних речовин КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 7 . Мила й інші поверхнево-активні речовини (миючі речовини) Під впливом невеликого надлишку розчину їдкого натру жири перетворюються на слизисту тягучу масу, мильний клей. При додаванні кухонної солі цей клей розділяється на водну фазу, що містить гліцерол, сіль і надлишок лугу, і спливаюче мильне ядро. Запам’ятайте: мила становлять собою солі вищих карбонових […]...
- Кількісний склад розчинів РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 12. Кількісний склад розчинів Усвідомлення змісту цього параграфа дає змогу: Пояснювати поняття “молярна концентрація”, “масова частка” розчиненої речовини; Вміти визначати зазначені поняття, обчислювати склад розчинів і виготовляти розчини з певною молярною концентрацією розчиненої речовини. Кількісний склад розчинів найчастіше виражається безрозмірною відносною величиною – […]...
- Приклади розв’язування типових задач – Урок 6 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині. Дано: Розв’язання Відповідь: w(NaCl) = 6,25 %. Задача 2. Натрій гідроксид, маса якого 10 […]...
- Кислоти й основи, за Льюїсом – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.3. Кислоти й основи, за Льюїсом Визначення, запропоноване Гілбертом Н. Льюїсом, не обмежується розглядом перенесення протонів. Згідно з цим визначенням, кислотами є частинки, атоми яких мають незаповнені валентні оболонки. Кислота – це частинка з незавершеною електронною конфігурацією. Основа є частинкою, яка надає пару електронів для утворення ковалентного […]...
- Способи кількісного вираження складу розчинів – РОЗЧИНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ РОЗЧИНИ Способи кількісного вираження складу розчинів Для кількісного опису складу розчину часто вживають величини: масова частка розчиненої речовини й молярність розчину. Окрім цих, є й менш популярні способи: мольна частка, моляльність, нормальність, титр, об’ємна частка тощо. Способів вираження концентрації досить багато, тому що […]...
- Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- Приклади розв’язування типових задач – Урок 8 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води. Дано: Розв’язання 1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), […]...
- КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ З хімічної точки зору оксид карбону (IV) – кислотний оксид із властивостями, характерними для даного класу неорганічних сполук. Йому відповідає карбонатна кислота Н2СО3. Це дуже нестійка сполука, у вільному вигляді не існує, та й у водних розчинах молекули карбонатної кислоти не виявляються. […]...
- Віскоза – Штучні волокна Матеріалознавство швейного виробництва ХІМІЧНІ ВОЛОКНА Штучні волокна Віскоза Виробництво віскози складається з: – підготовки целюлози; – приготування прядильного розчину; – формування волокна; – оздоблення. Підготовка целюлози складається з підсушування її до змісту вологи 6-8% і обробки 18-20% розчином їдкого натрію при температурі 40-45°С. Така обробка сприяє вилученню домішок з сировини; при цьому створюється так звана […]...
- Дисоціація води – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.12. Дисоціація води. pH Водa і як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами: Н2O ⇆ Н+ + ОН-. Концентрацію іонів звичайно виражають у молях […]...
- ВЛАСТИВОСТІ СУЛЬФАТНОЇ ТА НІТРАТНОЇ КИСЛОТ, СУЛЬФАТІВ I НІТРАТІВ ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 11. ВЛАСТИВОСТІ СУЛЬФАТНОЇ ТА НІТРАТНОЇ КИСЛОТ, СУЛЬФАТІВ I НІТРАТ ІВ Цілі: закріпити знання про сульфатну й нітратну кислоти, сульфати й нітрати, їх властивості; формувати вміння складати формули сполук і хімічні рівняння, що характеризують їх властивості. Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер. Тип уроку: закріплення (розвивальне диференційоване навчання). […]...
- Солі сульфатної кислоти – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.8. Солі сульфатної кислоти Сульфатна кислота, як двохосновна, утворює два ряди солей: середні, що називаються сульфатами, і кислі, що називаються гідросульфатами. Сульфати утворюються при повній нейтралізації кислоти лугом (на один моль кислоти припадає два молі лугу), а […]...
- Обчислення масової частки й маси речовини в розчині Тема 1 РОЗЧИНИ Урок 8 Тема уроку. Обчислення масової частки й маси речовини в розчині Цілі уроку: закріпити знання про масову частку розчиненої речовини; формувати навички й уміння обчислювати масову частку розчиненої речовини, застосовувати ці знання для обчислення маси розчиненої речовини, приготування розчинів із заданою масовою часткою розчиненої речовини. Тип уроку: застосування знань, умінь і […]...
- Розв’язування типових задач – АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 18. АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 18.7. Розв’язування типових задач Задача 1. Як можна добути анілін, виходячи з метану і не використовуючи інші органічні сполуки? Зазначте умови перебігу реакцій. Розв’язання. Проводячи піроліз метану, можна добути ацетилен: T 2СН4 -> С2Н2 + ЗН2. […]...
- Приготування розчинів Тема 1 РОЗЧИНИ Урок 9 Тема уроку. Приготування розчинів Цілі уроку: формування навичок і вмінь приготування розчинів; розвиток навичок розв’язання задач із використанням поняття “масова частка розчиненої речовини”, розрахунків, пов’язаних із приготуванням розчинів. Тип уроку: застосування вмінь і навичок. Форми роботи: самостійна робота під керівництвом учителя, виконання тренувальних завдань. Обладнання: таблиця розчинності, картки-завдання. ХІД УРОКУ […]...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...
- Структура карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.2 . Структура карбонових кислот Карбонові кислоти дисоціюють у воді з утворенням іонів карбоксилату та іонів гідроксонію: Центральний атом Карбону подвійним зв’язком з’єднаний з атомом Оксигену, який знаходиться у sp2-гібридному стані, тому карбоксильна група має плоску структуру. Протон гідроксильної групи в карбонових кислотах на відміну від протона гідроксильної […]...