Реальний газ. Рівняння стану реального газу
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ
4.9. Реальний газ. Рівняння стану реального газу
Досвід засвідчує, що закони, які характеризують ідеальний газ, у першому наближенні можна застосовувати до розріджених реальних газів. Для реальних газів з помірною та великою густиною відхилення від законів ідеального газу значні.
Для багатьох реальних газів взаємна потенціальна енергія частинок змінюється залежно від відстані між ними за законом Леннарда – Джонса:
Де перший член враховує притягання між частинками, а другий – відштовхування між ними. Загальний вигляд потенціалу Леннарда – Джонса зображено на рис. 4.4.
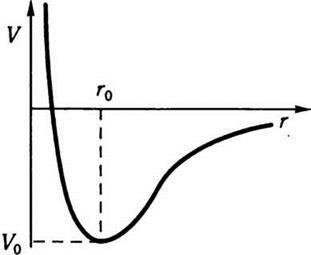
Рис. 4.4
Сили притягання між частинками реального газу називають вандерваальсовими силами за ім’ям голландського фізика Й. Ван дер Ваальса (1837-1923), який їх відкрив. Теорію вандерваальсових сил притягання розробив П. Дебай для газів, молекули яких мають сталий дипольний момент, В. Кеєзом – для газів, у яких лише частина молекул характеризується сталим дипольним моментом, і Ф. Лондон – для
Хоча нині відомо понад 150 рівнянь стану реальних газів, знайдених емпірично та теоретично, рівняння стану реального газу Ван дер Ваальса (1873 р.) не втратило свого наукового значення. Це пояснюється насамперед тим, що воно теоретично обгрунтоване і має порівняно простий вигляд. Для моля реального газу
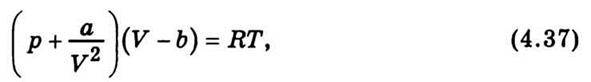
Де а/V2 – поправка на сили притягання між молекулами, або так званий внутрішній тиск газу; b – поправка на власний об’єм молекул. Важливим результатом рівняння Ван дер Ваальса є те, що воно припускає безперервний перехід між рідким і газоподібним станами. Порівнюючи теоретичні ізотерми Ван дер Ваальса з експериментальними ізотермами Ендрюса для СО, дійшли більш глибокого розуміння фізичного змісту як окремих ділянок ізотерм, що відповідають одно – та двофазним станам, так і критичного стану речовини.
На рис. 4.5 зображено ізотерми Ван дер Ваальса для різних температур (Т1 < Т2 < Т3 < T4). На цих ізотермах спостерігається s-подібна ділянка, яка тим більша, чим нижча температура, якій відповідає ізотерма. Щоб теорія Ван дер Ваальса принаймні якісно пояснювала фазові переходи, її формально доповнюють правилом Максвелла. Згідно з цим правилом горизонтальні прямі (штрихова лінія АG) проводять так, щоб площі s1 та s2, що відсікаються цією прямою та ізотермою Ван дер Ваальса, були однакові. Ізотерми з горизонтальною ділянкою збігаються з експериментальними ізотермами Ендрюса. Розглянемо уважніше ізотерми Ван дер Ваальса на прикладі ізотерми, що відповідає температурі T1. Відрізок G’G відповідає газоподібному стану, GА – двофазному стану рідина – пара, АА’ – рідкому стану, – переохолодженій парі, а аА – перегрітій рідині. Відрізок gа практично реалізувати неможливо, оскільки для станів, що відповідають цьому відрізку, зі збільшенням об’єму має зростати і тиск, тобто 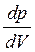 > 0, що суперечить умові стабільного стану. Криву АВСDЕFG називають бінодаллю. Вона відокремлює геометричне місце точок, що відповідають двофазним та метастабільним однофазним станам. Вершина цієї кривої збігається з критичною точкою D, а критична ізотерма, на відміну від інших ізотерм, має лише точку перегину. Для критичної точки
> 0, що суперечить умові стабільного стану. Криву АВСDЕFG називають бінодаллю. Вона відокремлює геометричне місце точок, що відповідають двофазним та метастабільним однофазним станам. Вершина цієї кривої збігається з критичною точкою D, а критична ізотерма, на відміну від інших ізотерм, має лише точку перегину. Для критичної точки
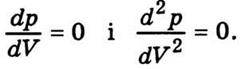
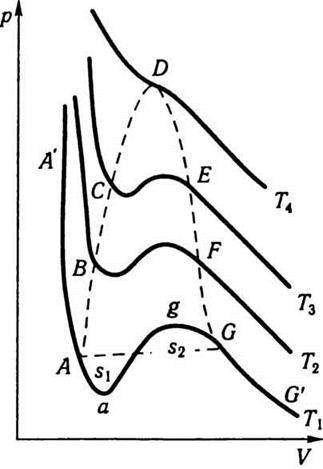
Рис. 4.5
Тоді з рівняння Ван дер Ваальса неважко дістати значення критичних параметрів через сталі а і b:
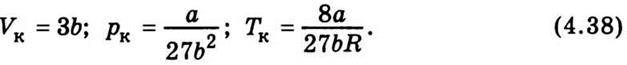
Зауважимо, що хоча рівняння Ван дер Ваальса і правильно передає основні закономірності поведінки реальних газів, проте кількісні результати, добуті за допомогою цього рівняння, не завжди задовільні. Тому виникла потреба пошуку інших, більш точних рівнянь стану.
Однією з причин недосконалості рівняння Ван дер Ваальса є те, що в цьому рівнянні не береться до уваги можливість асоціації молекул, тобто утворення груп. Сучасні експериментальні та теоретичні дослідження свідчать про те, що в газах, навіть за високих температур, молекули утворюють групи з двох, трьох, чотирьох і більше молекул. Чим нижча температура, тим більше багатоатомних молекулярних комплексів, тим міцніший зв’язок між молекулами в групі. За певних умов починається процес інтенсивного групоутворення – процес конденсації.
Теорія реальних газів набула помітного розвитку внаслідок застосування нових статистичних методів, запропонованих М. М. Боголюбовим, Р. Майєром та іншими вченими.
Рівняння стану реальних газів, виведене статистичними методами, має такий вигляд:
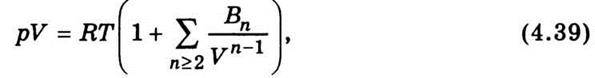
Де Вп – віріальні коефіцієнти, які можна розрахувати, якщо відомий характер взаємодії між молекулами.
