Розподіл електронів в атомі по енергетичних рівнях
ФІЗИКА
Частина 5 АТОМНА ФІЗИКА
Розділ 15 БУДОВА АТОМА
15.8. Розподіл електронів в атомі по енергетичних рівнях
З підрозділу 15.7 відомо, що електрони в атомі можуть перебувати в різних стаціонарних станах. Кожний з цих станів можна охарактеризувати чотирма квантовими числами: n, l, ml mS, де n – головне квантове число, яке визначає розміри орбіти електрона, а також енергію електрона в атомі; l – орбітальне квантове число, що визначає орбітальний момент імпульсу (орбітальний механічний момент) електрона в атомі і ексцентриситет (ступінь
Якщо атом збуджений, то електрони в ньому можуть перебувати в будь-якому з можливих стаціонарних станів, яких, взагалі, досить багато. Випромінюючи відповідний за значенням квант світла, атом переходить зі збудженого стану в так званий нормальний стан. З’ясуємо, в яких станах перебувають електрони в такому
Будь-який атом можна йонізувати, вириваючи з нього електрони. Для цього треба виконати роботу, яка дорівнює абсолютному значенню енергії стаціонарного стану, в якому перебуває електрон. Так, щоб вилучити електрон з атома гідрогену потрібно затратити енергію 13,5 еВ. Якби всі електрони незбудженого багатоелектронного атома перебували в одному стаціонарному стані, то на вилучення кожного з електронів треба було б затратити ту саму кількість енергії. Якщо ж електрони в такому атомі перебувають у різних енергетичних станах, то не однаково, який з них вилучається. Робота з вилучення електрона матиме в цьому разі кілька значень: відповідно до того, у скількох стаціонарних станах перебувають електрони в атомі.
Дослід засвідчує, що робота з виривання електрона з атома (робота йонізації) за винятком атомів гідрогену і гелію набуває кількох значень. Для літію і берилію таких значень два, для бору і карбону – три. У атомів більш важких елементів робота йонізації набуває ще більше різних значень. Отже, електрони в незбудженому атомі перебувають у різних стаціонарних станах. У зв’язку з цим виникає запитання, в яких саме стаціонарних станах перебувають електрони в такому атомі. Відповісти на нього можна, виходячи з фундаментального принципу квантової механіки, висунутого 1924 р. швейцарським фізиком В. Паулі.
За принципом Паулі, електрони, що входять до складу якої-небудь системи, зокрема внутрішньоатомні електрони, не можуть перебувати в тотожних станах руху. Інакше кажучи, в будь-якому ста ціонарному стані, що характеризується сукупністю чотирьох квантових чисел n, l, ml і mS, не може перебувати більше одного електрона. Стан, в якому перебуває електрон, називають заповненим. Якщо користуватись уявленням теорії Бора, то принцип Паулі означає, що два або більше електронів не можуть рухатись по спільній орбіті, маючи однакові напрями спінів. Беручи до уваги, що відповідно до двох значень спінового квантового числа (mS =±1/2) можуть бути дві орієнтації спіну електрона, принцип Паулі можна сформулювати так: у системі (зокрема, в атомі) не може бути більше двох електронів, рух яких характеризується однаковими значеннями трьох квантових чисел n, l, ml.
Оскільки при заданому значенні орбітального квантового числа l магнітне квантове число набуває 2l + 1 значень, то в складних багатоелектронних атомах число електронів, що характеризується однаковими значеннями двох квантових чисел n і l, не перевищує 2(2l + 1). Отже, якщо атом має досить багато електронів, то серед електронів, стан руху яких характеризується однаковим головним квантовим числом n, не може існувати більше двох s-електронів (l = 0), шести р-електронів (l = 1), десяти d-електронів (l = 2), чотирнадцяти f-електронів (l = 3), вісімнадцяти g-електронів (l = 4) і т. д.
Користуючись принципом Паулі, визначимо максимальне число електронів Z(n), що перебувають у станах, які характеризуються значенням n головного квантового числа. Оскільки при зданому п орбітальне квантове число l змінюється від 0 до n – 1, то, використовуючи формулу для суми членів арифметичної прогресії, дістанемо
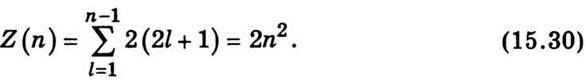
Сукупність електронів, які перебувають у всіх можливих станах з однаковим значенням головного квантового числа n, утворює електронну оболонку (електронний шар). Електронні шари прийнято позначати великими латинськими літерами відповідно до значення головного квантового числа. Найближче до ядра розташований K-шар, для якого n = 1, далі – L-шар (n = 2), М-шар (n = 3), N-шар (n = 4) тощо. Згідно з формулою (15.30) у K-шарі може перебувати не більше ніж два електрони (два s-електрони); в L-шарі – не більше ніж вісім (з них два в s-стані і шість у р-стані). У М-шарі максимально може міститись вісімнадцять електронів, з них два s-електрони, шість – р-електронів і десять d-електронів і т. д. Схематично електронні шари в атомі зображено на рис. 15.6. Електрони, що мають однакову пару квантових чисел n і l, утворюють підгрупу. Оскільки для n = 1 l може дорівнювати тільки нулю, то в цьому шарі є тільки одна підгрупа. Число електронів у шарі з n = 1 дорівнює 2n2 = 2 ∙ 12 =2. Число електронів у підгрупі з l=0 також дорівнює 2, оскільки в цьому разі 2(2l +1) = 2. Для n = 2 число електронів 2n2 = 8 і l набуває двох значень: 0; 1. Число електронів для l = 0 і l = 1 відповідатиме 2 і 6. Для n = 3 загальне число електронів у шарі 2n2 = 18 і l набуватиме трьох значень: 0; 1; 2; матимемо три підгрупи електронів з числом електронів 2, 6, 10. Аналогічно можна проаналізувати розподіл електронів по підгрупах зі значеннями для n 4; 5; 6 і т. д. Як зазначалося, електрони, що входять у підгрупи зі значеннями 0; 1; 2; 3; … для l, називають відповідно s-, р-, d-, f-електронами тощо. Стани електронів в атомі прийнято записувати так: головне квантове число n – цифрою, а число l – відповідною літерою. Тоді стан електрона в K-шарі (n = 1, l= = 0) треба записати символом 1s, у шарі l(n = 2) при l = 0 – символом 2s, а при l = 1 – символом 2р. Так само можна розписати стани електронів для інших шарів:
М-шар | (n = 3) | М-шар | (n = 4) |
L = 0 | Зs | L = 0 | 4s |
L = 1 | Зр | L = 1 | 4р |
L = 2 | 3d | L = 2 | 4d |
L = 3 | 4f |
Викладені тут теоретичні положення про розподіл електронів по шарах (оболонках) дають змогу зрозуміти, чим визначається періодичність у властивостях елементів, яку виявив Д. І. Менделєєв.
