Розв’язування типових задач
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ.
§ 4.8. Розв’язування типових задач
Задача 1. Реакція за температури 50° С відбувається за 2 хв 15 с. За який час закінчиться ця реакція за температури 70°С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює З?
Розв’язання. Із збільшенням температури від 50 до 70°С швидкість реакції відповідно до правила Вант-Гоффа збільшується:
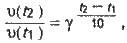
Де t2 = 70°С,
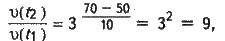
Тобто швидкість збільшується в 9 разів.
Відповідно до означення швидкість реакції обернено пропорційна часу перебігу реакції, отже:
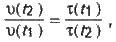
Де τ (t1) і τ (t2) – час перебігу реакції за температур t1 і t2.
Звідси маємо:
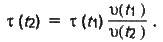
Враховуючи, що х (t1) = 135 с (2 хв 15 с), визначаємо час перебігу реакції за температури t2:
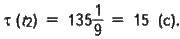
Задача 2. У системі
А + В⇆ С, ∆Н° < 0,
Де А, В і С – гази, встановилася рівновага. Як впливатимуть на рівноважну концентрацію
Розв’язання, а) Під час перебігу реакції загальне число молів газуватих речовин зменшується з 2 до 1. Відповідно до принципу Ле Шательє підвищення тиску призведе до зміщення рівноваги в бік меншого числа молів газуватих речовин (тобто в бік утворення речовини С), отже, збільшиться.
Б) Збільшення концентраці речовини А призведе до зміщення рівноваги в бік утворення продукту С, тобто збільшиться.
В) Оскільки ∆Н˚ < 0, теплота виділяється, реакція – екзотермічна. Зворотна реакція обов’язково буде ендотермічною. Підвищення температури завжди сприяє перебігу реакції з поглинанням теплоти, тобто рівновага зміститься в бік речовин А та В і зменшиться.
Задача 3. Як впливатиме підвищення тиску на хімічну рівновагу в оборотній системі
Fe3O4 (т) + СО (г) ⇆ 3FeO (т) + СО2 (г) ?
Розв’язання. Запишемо вирази для швидкостей прямої (vпр) і зворотної (vзвор) реакцій:
Vпp = kпр ; vзвор = kзвор.
Швидкості прямої і зворотної реакцій не залежать від концентрацій твердих речовин. За підвищення тиску в два рази в таке саме число разів збільшуються концентрації СО і СО2. Отже, швидкості прямої і зворотної реакцій збільшаться в однакове число разів, і рівновага в системі не зміститься.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ХІМІЧНА РІВНОВАГА Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює Швидкості його розкладання на SO2 і O2: За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту […]...
- ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Швидкість реакції – це кількість речовини, що реагує за одиницю часу. Залежно від умов одна і та ж реакція може протікати з різною швидкістю. Так, при збільшенні кількості речовини, що реагує в одиниці об’єму, тобто його концентрації, швидкість реакції зростає, тому що зростає число зіткнень частинок, що […]...
- Розв’язування типових задач – АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 18. АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 18.7. Розв’язування типових задач Задача 1. Як можна добути анілін, виходячи з метану і не використовуючи інші органічні сполуки? Зазначте умови перебігу реакцій. Розв’язання. Проводячи піроліз метану, можна добути ацетилен: T 2СН4 -> С2Н2 + ЗН2. […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Принцип Ле Шательє ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.7. Принцип Ле Шательє Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску (для газових реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівноваги, або принципу Ле Шательє: Якщо на систему, […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- Енергія активації ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.3. Енергія активації Значну зміну швидкості реакції зі зміною температури пояснює теорія активації. Згідно з цією теорією в хімічну взаємодію вступають тільки активні молекули (частинки), що мають енергію, достатню для здійснення даної реакції. Неактивні частинки можна […]...
- Необоротні й оборотні реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.5. Необоротні й оборотні реакції Реакції, які відбуваються тільки в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад хлорату калію (бертолетової солі) під час […]...
- Приклади розв’язування типових задач – Урок 7 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Складіть молекулярне рівняння, що відповідає такому скороченому йонно-молекулярному рівнянню: Розв’язання Йонно-молекулярне рівняння реакції показує, що під час реакції відбулось зв’язування йонів Купруму Сu2+ і сульфід-іонів S2- в нерозчинну сполуку купрум(ІІ) сульфід CuS, тобто […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач Суть розв’язування задач цього типу полягає в розстановці коефіцієнтів і перетворенні схем реакцій на рівняння. Задача 1. Схема реакції: Ставимо коефіцієнт 4 перед формулами NH3 і NO, а коефіцієнт 5 – перед формулою O2: Залишається дібрати […]...
- Розв’язування типових задач – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 17.19. Розв’язування типових задач Задача 1. Етанол об’ємом 30 мл (густина 0,79 г/мл) нагріли з надлишком броміду натрію і сульфатної кислоти. З реакційної суміші виділили брометан масою 42,3 г. Обчисліть масову частку виходу брометану. Розв’язання. При […]...
- Тема 4. Закономірності перебігу хімічних реакцій – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 4. Закономірності перебігу хімічних реакцій Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте назву реакцій, що перебігають з виділенням теплоти: A. Ендотермічні; Б. Оборотні; В. Необоротні; Г. Екзотермічні. 2. Позначте вірне […]...
- Розв’язування типових задач – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ §11.10. Розв’язування типових задач Задача 1. Під час прожарювання кристалогідрату CuSO4 ∙ 5Н2O масою 10,0 г відбулося часткове видалення води. Визначте формулу добутого кристалогідрату, якщо його маса дорівнює 7,84 г. Розв’язання. Складаємо рівняння реакції: CuSO4 ∙5Н2О = CuSO4 […]...
- Середня і миттєва швидкість – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.2 . Середня і миттєва швидкість У ході реакції її швидкість зазвичай зменшується. Тобто швидкість реакції непостійна. Наведені вище значення швидкості є лише середніми значеннями. Математично середня швидкість у певному інтервалі часу між t1 і t2 визначається з нахилу січної на діаграмі залежності концентрації від часу. Увага: при експериментальному […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- РЕАКЦІЇ РОЗКЛАДУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ РОЗКЛАДУ З назви “реакція розкладу” також випливає, про який тип реакцій іде мова. У реакції розкладу відбувається розкладання складної речовини на декілька речовин. Продуктами реакції можуть бути як прості, так і складні речовини. Наприклад: Майже всі вказані реакції, як і переважна більшість інших реакцій розкладу, ендотермічні. Для […]...
- Розв’язування типових задач Оксиди, кислоти, основи, солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.7. Розв’язування типових задач Оксиди, кислоти, основи, солі Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення; CuSO4 -> Сu -> СuО -> СuСl2 -> Сu(OН)2 -> Cu(OH)NO3 -> Сu(NO3)2. Розв’язання. 1) […]...
- Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.14. Розв’язування типових задач Масова частка розчиненої речовини Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину. Розв’язання. Обчислюємо […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- РЕАКЦІЇ СПОЛУЧЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ СПОЛУЧЕННЯ Уже сама назва “реакція сполучення” говорить про її тип. У результаті сполучення декількох речовин утворюється одна нова речовина. Практично завжди в реакцію сполучення вступає не більше двох речовин; ці речовини можуть бути як простими, так і складними. Приклади реакцій сполучення: У переважній більшості реакції сполучення є […]...
- Каталіз ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 4. Каталіз Багато реакцій, які відповідно до енергетичних передумов повинні відбуватися спонтанно, не починаються або проходять дуже повільно. Приклад. Для процесу утворення газоподібної води з водню і кисню при 25 °С енергія Гіббса реакції ∆G°298 = -229 кДж/моль. Проте суміш водню і кисню може зберігатися як завгодно довго, реакція за цих умов […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Приклади розв’язування типових задач – Урок 8 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води. Дано: Розв’язання 1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
- Приклади розв’язування типових задач – Урок 6 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині. Дано: Розв’язання Відповідь: w(NaCl) = 6,25 %. Задача 2. Натрій гідроксид, маса якого 10 […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- Розв”язання типових задач ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.12 Розв”язання типових задач Періодичний закон Д. І. Менделєєва, ізотопи Задача 1. В якій групі і якому періоді періодичної системи елементів Д. І. Менделєєва перебуває елемент з порядковим номером 42? Розв’язання. […]...
- Виведення формули сполуки – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач VI. Виведення формули сполуки Зауважимо, що співвідношення значень індексів у формулі речовини дорівнює співвідношенню кількості атомів елементів у сполуці та відповідно співвідношенню кількостей речовини елементів. Отже, для речовини, формула якої Р2O5, можна записати: Якщо […]...