Швидкість хімічної реакції, залежність швидкості реакції від різних факторів
Тема 2
ХІМІЧНІ РЕАКЦІЇ
Урок 23
Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів
Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; формувати навички розв’язання задач із використанням поняття “швидкість хімічної реакції”.
Тип
Форми роботи: фронтальне опитування, демонстраційний експеримент, індивідуальна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, плакат із правилами техніки безпеки в кабінеті хімії.
Демонстрація 5. Залежність швидкості хімічної реакції металів із хлоридною кислотою від природи металу й концентрації кислоти.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Розв’язування задач
Усі учні розв’язують
1) У 1000 г розчину сульфатної кислоти міститься 5 моль кислоти.
Обчисліть масову частку кислоти в розчині.
2) Обчисліть кількість речовини натрій гідроксиду в 1000 г 25% – го розчину.
Відповіді учнів перевіряються, порівнюються з відповідями, отриманими в класі.
2. Фронтальне опитування
– Що таке масова частка розчиненої речовини?
– Що таке молярна концентрація?
– Які фактори впливають на розчинність речовин у воді?
– Назвіть умови протікання хімічних реакцій.
– Чи можна стверджувати, що з киснем реагують усі метали?
– Чому реакцію “іржавіння” натрію можна побачити відразу після потрапляння натрію на повітря, а іржавіння заліза у вологому повітрі відбувається значно повільніше?
III. Вивчення нового матеріалу
Швидкість хімічної реакції
Реакції протікають з різною швидкістю.
За яким критерієм можна судити про швидкість протікання хімічної реакції? Таким критерієм може бути зміна вмісту реагентів і продуктів реакції. Концентрація вихідних речовин із часом зменшується, а продуктів реакції – збільшується. Для кількісної характеристики хімічних реакцій використовують поняття “швидкість хімічної реакції”, що визначається зміною концентрації одного з реагентів за одиницю часу:
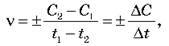
Де C і C2 – молярні концентрації речовин у моменти часу t1 і t2 відповідно (знак (+) – якщо швидкість визначається за продуктами реакції, знак (-) – за вихідними речовинами). Реакції протікають у разі зіткнення молекул реагентів. Швидкість реакції визначається кількістю зіткнень та ймовірністю того, що вони приведуть до хімічного перетворення. число зіткнень визначається концентраціями реагентів, а ймовірність реакції – енергією молекул, що зіштовхуються.
Розглянемо фактори, що впливають на швидкість хімічних реакцій.
1. Природа реагентів. Чималу роль відіграє характер хімічних зв’язків і будова молекул реагентів. Реакції протікають у напрямі руйнування менш міцних зв’язків і утворення речовин з більш міцними зв’язками. Так, для розриву зв’язків у молекулах Н2 і N2 потрібні високі енергії; такі молекули мало реакційно-здатні. Для розриву зв’язків у дуже полярних молекулах (HCl, H2О) потрібно менше енергії, і швидкість реакції значно вища. Реакції між іонами в розчинах електролітів протікають практично миттєво.
Наприклад, флуор з воднем реагує з вибухом за кімнатної температури, бром із воднем взаємодіє повільно й у процесі нагрівання.
Кальцій оксид вступає в реакцію з водою енергійно, з виділенням тепла; оксид Купруму – не реагує.
Демонстрація 5. У три пробірки з розчином хлоридної кислоти зануримо по шматочку цинку, магнію й заліза. Чому швидкість виділення бульбашок водню в пробірках різна? (Для пояснення звертаємося до ряду активності металів.)
2. Концентрація. Зі збільшенням концентрації (кількості частинок в одиниці об’єму) зіткнення молекул реагентів відбуваються частіше – швидкість реакції зростає.
Демонстрація 5. У три пробірки наливаємо розчин хлоридної кислоти, розведеної у співвідношеннях 1:2, 1:5 і 1:10. У кожну додаємо гранулу цинку. У розчині з більшою чи з меншою концентрацією швидкість реакції вища?
(Цю закономірність у 1867 р. установили К. Гульдберг і П. Вааге як закон діючих мас.)
Швидкість хімічної реакції прямо пропорційна добутку концентрацій реагентів:
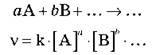
Константа швидкості реакції k залежить від природи реагентів, температури й каталізатора, але не залежить від значення концентрацій реагентів. Фізичний зміст константи швидкості полягає в тому, що вона дорівнює швидкості реакції за одиничних концентрацій реагентів.
(Для гетерогенних реакцій концентрація твердої фази у вираз швидкості реакції не входить.)
3. Температура. У разі підвищення температури на кожні 10 °C швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа). Унаслідок підвищення температури від t1 до t2 зміну швидкості реакції можна обчислити за формулою:
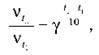
Де vt1 і vt2 – швидкості реакції за температур t2 і t1 відповідно;
? – температурний коефіцієнт реакції.
Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Ea називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення.
Чим більша енергія активації Ea, тим активніше зростає швидкість реакції внаслідок підвищення температури.
Цю залежність можна простежити на енергетичній діаграмі в підручнику (або на проекторі).
Енергетична діаграма хімічної реакції
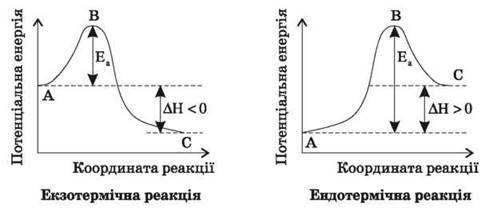
А – реагенти; В – активований комплекс (перехідний стан); С – продукти.
4. Поверхня зіткнення реагентів. Для гетерогенних систем (коли речовини перебувають у різних агрегатних станах) чим більша поверхня зіткнення, тим швидше протікає реакція. Поверхня твердих речовин може бути збільшена шляхом їх подрібнення, а для розчинних речовин – шляхом їх розчинення.
Демонстрація 5. У дві пробірки наллємо розчин хлоридної кислоти. Потім в одну з них зануримо шматочок заліза, а в другу додамо шпателем порошок заліза. У якій пробірці швидкість хімічної реакції більша?
5. Каталіз. Речовини, які беруть участь у реакціях і збільшують її швидкість, залишаючись до кінця реакції незмінними, називаються каталізаторами. механізм дії каталізаторів пов’язаний зі зменшенням енергії активації реакції за рахунок утворення проміжних сполук. У процесі гомогенного каталізу реагенти й каталізатор складають одну фазу (перебувають в одному агрегатному стані), під час гетерогенного каталізу – різні фази (перебувають у різних агрегатних станах). Різко вповільнити протікання небажаних хімічних процесів у деяких випадках можна, додаючи в реакційне середовище інгібітори (явище “зворотного каталізу”).
IV. Первинне застосування одержаних знань (керована практика)
Завдання 1
Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов висновку:
А) швидкість реакцій зростає з підвищенням температури;
Б) швидкість реакцій прямо пропорційна концентрації реагентів;
В) із часом швидкість реакцій збільшується;
Г) швидкість реакцій можна змінити, використовуючи каталізатор.
Поясніть, у якому з пунктів учень припустився помилки.
Завдання 2
А) Концентрація одного з реагентів через 20 секунд після початку реакції становила 0,1 моль/л, а через 30 секунд – 0,02 моль/л. Обчисліть середню швидкість цієї реакції.
Б) Обчисліть середню швидкість реакції, якщо відомо, що концентрації речовини змінилися так:
1) з 0,5 моль/л до 0, 2 моль/л за 20 секунд;
2) з 0,15 моль/л до 0,1 моль/л за 30 секунд.
В) Унаслідок підвищення температури на 30 °С для реакції, температурний коефіцієнт якої дорівнює 3, швидкість реакцій збільшується:
1) у 3 рази;
2) у 6 разів;
3) у 9 разів;
4) у 27 разів.
Поясніть, як ви проводили розрахунок.
Г) У разі підвищення температури на 20 °С для реакції, що має температурний коефіцієнт 2, швидкість реакції збільшиться:
1) у 2 рази;
2) у 3 рази;
3) у 4 рази;
4) у 6 разів.
Дайте пояснення своїм розрахункам.
Д) Реакція за температури 40 °С протікає за 180 с. Температурний коефіцієнт реакції дорівнює 3. За скільки секунд завершиться ця реакція за температури 60 °С?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
