Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
Складання рівнянь окисно-відновних Реакцій
При складанні рівнянь ОВР дуже часто користаються методом електронного балансу та методом електронно-іонного балансу (метод напівреакцій). їх використовують для підбору стехіометричних коефіцієнтів у рівняннях ОВР.
Метод електронного балансу
Суть методу знаходження стехіометричних коефіцієнтів у рівняннях ОВР полягає в тому, щоб визначити ступені окиснення атомів
1. Записати реагенти й продукти реакції в молекулярному вигляді.
2. Визначити ступені окиснення всіх елементів, які входять до складу реагентів та продуктів реакції.
3. Визначити, які елементи змінюють ступені окиснення.
4. Записати рівняння окиснення та відновлення із зазначенням числа прийнятих і відданих електронів.
5. Знайти найменше спільне кратне для чисел відданих і прийнятих електронів й обчислити коефіцієнти, на які необхідно помножити
6. Записати сумарне рівняння окиснення й відновлення.
7. Розставити коефіцієнти у вихідному молекулярному рівнянні.
Розгляньмо простий приклад відновлення ферум(ІІІ) оксиду чадним газом (карбон монооксидом). Продуктом реакції є залізо та карбон діоксид (вуглекислий газ):
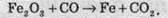
Обчислимо ступені окиснення всіх елементів:
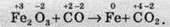
У даному разі ступені окиснення змінюють елементи Ферум (від +3 до 0) та Карбон (від +2 до +4). Виходячи зі зміни ступеня окиснення цими елементами, запишемо рівняння окиснення та відновлення:

При складанні рівнянь окиснення та відновлення іноді складно визначити число прийнятих або відданих електронів. Для цього можна згадати закон збереження заряду: сумарні заряди лівої й правої частин рівнянь мають бути однаковими. При цьому не можна також забувати про те, що електрон має заряд -1. Таким чином, щоб визначити число електронів у першому рівнянні (відновлення), молена скласти математичний вираз, позначивши число електронів символом х: +3 + х ∙ (-1) = 0. Розв’язуючи це рівняння, знаходимо, що х = 3, отже, щоб заряд +3 перетворився на 0, необхідно прийняти 3 електрони. Таку саму операцію виконуємо стосовно другого рівняння: +2 + х ∙ (-1) = +4. У цьому разі х = -2, отже, для того щоб заряд +2 перетворився на +4, необхідно віддати 2 електрони (про необхідність віддавати електрони свідчить від’ємний знак значення х).
Наступним етапом буде визначення найменшого спільного кратного для чисел відданих і прийнятих електронів. Для чисел 3 та 2 найменшим спільним кратним є число 6. Тепер, щоб визначити коефіцієнт, на який необхідно помножити рівняння окиснення й відновлення, поділимо найменше спільне кратне на число електронів, які беруть участь у кожному рівнянні. У рівнянні відновлення беруть участь 3 електрони, отже, це рівняння треба помножити на 6/3 = 2. У рівнянні окиснення беруть участь 2 електрони, отже, його б треба помножити на 6/2 = 3. Отримане найменше спільне кратне та коефіцієнти записуємо праворуч від рівнянь:

Тепер підсумуємо рівняння окиснення та відновлення з урахуванням коефіцієнтів: усі члени першого рівняння множимо на 3, а другого – на 2. Очевидно, що після множення в першому рівнянні приймається б електронів, а в другому – віддається б електронів. Після підсумовування вони скорочуються, тому в сумарному рівнянні їх можна не вказувати. Власне, суть електронного балансу полягає в тому, щоб визначити коефіцієнти, при множенні на які число прийнятих електронів буде дорівнювати числу відданих. Після всіх зазначених операцій одержуємо:

Залишається остання операція: перенести коефіцієнти із сумарного рівняння в молекулярне рівняння реакції. Для цього необхідно коефіцієнти перед відповідними частинками поставити перед записом молекул, до складу яких входять елементи із цими ж ступенями окиснення. Так, Fe+3 входить до складу ферум(ІІІ) оксиду, тому перед Fe2O3 необхідно поставити коефіцієнт 2, але оскільки до складу Fe2O3 уже входить два атоми Феруму, то коефіцієнт тут не потрібний; С+2 входить до складу карбон монооксиду, тому перед СО ставлять коефіцієнт 3. Аналогічно переносять і решту коефіцієнтів і одержують:
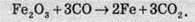
Часто бувають випадки, коли в рівнянні є сполуки, до складу яких не входять елементи, що змінюють ступінь окиснення. У цьому разі коефіцієнти перед такими сполуками ставлять в останню чергу. Розгляньмо випадок взаємодії міді з концентрованою нітратною кислотою:
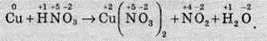
У цьому разі змінюють ступені окиснення Купрум і Нітроген. Складемо для них електронний баланс:

У цьому разі перед сполуками, до складу яких входить Купрум (Cu і Cu(N03)2), стоїть коефіцієнт 1, а перед сполуками з Нітрогеном (HNO3 та NO2) – 2. Але, як видно з рівняння, не всі атоми Нітрогену змінюють ступені окиснення: частина їх без змін входить до складу купрум(ІІ) нітрату й для обчислення коефіцієнта перед нітратною кислотою їх також треба враховувати. Оскільки перед атомами Купруму коефіцієнт одиниця, то для утворення однієї “молекули” купрум(ІІ) нітрату витрачається два атоми Нітрогену. До цього слід додати ще два атоми Нітрогену, які витрачаються на утворення нітроген діоксиду, й тоді перед HNO3 треба поставити коефіцієнт 4. Після цього обчислюємо коефіцієнт перед Н2O. Серед реагентів Гідроген входить тільки а нітратну кислоту. З урахуванням коефіцієнта перед нею в реакції беруть участь 4 атоми Гідрофону, отже перед водою має стояти коефіцієнт 2. Виходячи із цього, одержуємо:
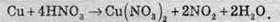
Якщо після всіх міркувань ви все ж таки маєте сумнів у правильності розставлених коефіцієнтів, то їх можна перевірити-за допомогою так званої контрольної суми. Зазвичай таку перевірку проводять за числом атомів Оксигену, тому що він входить до більшості сполук: сума атомів Оксигену у всіх реагентах має дорівнювати сумарному числу атомів Оксигену в продуктах реакції. У цьому разі і в реагентах, і в продуктах реакції сума атомів Оксигену дорівнює 12, отже, коефіцієнти розставлені правильно.
Окрім того, слід сказати ще про одну особливість складання рівнянь окиснення та відновлення. Часто серед продуктів або реагентів зустрічаються прості речовини, які складаються з двохатомних молекул (O2, Сl2, Вr2 тощо). Тільки в цьому випадку в рівняннях окиснення й відновлення ці речовини записують у вигляді молекул. Наприклад, розгляньмо взаємодію етилену з киснем:
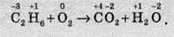
У цьому разі ступені окиснення змінюють атоми Карбону й Оксигену. Однак оскільки в реакції бере участь кисень, то в напівреакції відновлення слід записувати молекулу кисню. Але індекс при атомі Карбону в етилені при складанні напівреакції окиснення не враховується. У підсумку одержуємо:

При розстановці коефіцієнтів у молекулярному рівнянні необхідно враховувати, що в молекулу етилену входять два атоми Карбону. Окрім того, у продуктах реакції атоми Оксигену входять в обидва продукти, отже коефіцієнт перед Н2O ставлять за залишковим принципом: перед СO2, виходячи із сумарного рівняння, необхідно поставити коефіцієнт 4, отже, на карбон діоксид витрачається 8 атомів Оксигену, тоді на воду залишається 6 і перед Н2O ставлять коефіцієнт 6:
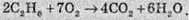
Звісно ж, розглянуті приклади є досить простими й у наведених рівняннях реакцій коефіцієнти можна розставити й без застосування електронного балансу, але існує досить багато реакцій, в яких без балансу розставити коефіцієнти складно.
