Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага
КИСЛОТИ Й ОСНОВИ
2. Протолітична рівновага
2.3. Сила кислот і основ
Слабкі кислоти й основи
У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули.
Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги:
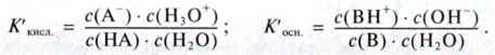
Оскільки в цьому випадку концентрація молекул води набагато більша, ніж концентрація іонів (Н3О+) і (ОН-), а с(Н2О) залишається практично незмінною, то її можна об’єднати
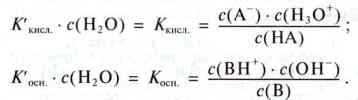
Константа Ккисл. – константа кислоти, константа Косн. – константа основи. Для слабких кислот і основ ці константи дуже малі.
Приклад. Етанова (оцтова) кислота – слабка кислота. При 25 °С вона дисоціює за схемою: НАс + Н2О = Н3О+ + Ас-, константа кислоти Ккисл. = 1,74 ∙ 10-5 моль/л.
У реакції NH3 + Н2О  NH4+ + ОН – при 25 °С константа основи Косн. = 1,78 ∙ 10-5 моль/л.
NH4+ + ОН – при 25 °С константа основи Косн. = 1,78 ∙ 10-5 моль/л.
Як і для водневого показника, так і для кислот та основ константа вказується у вигляді негативного десяткового логарифма:
Приклад. Значення рКкисл. етанової кислоти становить 4,76. Значення рКосн. амоніаку – 4,75.
Чим більше значення рКкисл. або значення рКосн., тим слабша відповідна кислота або основа.
Між значенням рКкисл. кислоти і значенням рКосн. зв’язаної основи існує така проста взаємозалежність:
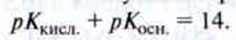
Чим сильніша кислота, тим слабша зв’язана основа.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Кислоти й основи, за Льюїсом – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.3. Кислоти й основи, за Льюїсом Визначення, запропоноване Гілбертом Н. Льюїсом, не обмежується розглядом перенесення протонів. Згідно з цим визначенням, кислотами є частинки, атоми яких мають незаповнені валентні оболонки. Кислота – це частинка з незавершеною електронною конфігурацією. Основа є частинкою, яка надає пару електронів для утворення ковалентного […]...
- Розвиток понять “кислоти” й “основи” – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості: – кислий смак; – розчиняють неблагородні метали, виділяючи водень; – розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду; – змінюють забарвлення індикаторів. До основ відносяться речовини, водні розчини яких (луги) мають такі властивості: – мильні на дотик; […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Теорія Бренстеда – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.2. Теорія Бренстеда Багато речовин утворюють кислі або лужні розчини, але не відповідають наведеним визначенням кислот і лугів. Приклад. Розчин амоній хлориду має кислу реакцію, а розчин натрій ацетату – лужну. У зв’язку з цим Йоганн Бренстед і Томас Лоурі сформулювали в 1923 р. нове визначення кислот […]...
- Значення pH буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Суміш слабкої кислоти і зв’язаної основи, або слабкої основи і її зв’язаної кислоти характеризується тим, що її водневий показник при додаванні не дуже великої кількості іонів гідроксонію або гідроксид-іонів практично не змінюється. Розчини, показник pH яких по відношенню до кислот і лугів залишається стабільним, називають буферними […]...
- Проведення титрування – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Проведення титрування Для визначення концентрації кислоти або лугу потрібне таке приладдя: – піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації; – бюретка для вимірювання розчину відомої концентрації; – Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації. Після додавання […]...
- Індикатори – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Титрування – це кількісний спосіб визначення невідомої концентрації розчину. При титруванні методом нейтралізації шукана концентрація кислоти визначається за допомогою лугу відомої концентрації. Індикатори Для визначення точки еквівалентності необхідний кислотно-основний індикатор. Такий індикатор є найчастіше слабкою кислотою, яка має інше забарвлення, відмінне від відповідної зв’язаної основи. […]...
- Водневий показник розчинів солей – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.4. Водневий показник розчинів солей Багато сольових розчинів мають нейтральне середовище, деякі – кисле або лужне. За Бренстедом, вода при цьому виконує функцію основи або кислоти. Приклад. Натрій хлорид Іон Na+: не вступає в реакцію з водою. Іон Сl-: надзвичайно слабка основа, тому протоліз не відбувається. Розчин натрій хлориду […]...
- Вибір індикатора – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Вибір індикатора Для визначення точки еквівалентності при титруванні потрібно мати відповідний індикатор, зміна кольору якого відбувається в межах області значень pH, в якій крива титрування проходить вертикально. Запам’ятайте: – Крива титрування сильних лугів сильними кислотами має велику (область значень pH по вертикалі. Для визначення точки […]...
- Іонний добуток води – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага Рівновага, яка виникає в процесі протолізу, залежить від температури, хімічної природи реагентів і зміщується в бік утворення стійкіших сполук. 2.1. Іонний добуток води Молекула води, згідно теорії Бренстеда, може виступати як кислота або як основа. І навіть у чистій воді відбувається так званий автопротоліз (грец. autos – сам): Проте […]...
- Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.7. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації Згідно з теорією електролітичної дисоціації, кислоти – це сполуки, які дисоціюють на катіони Гідрогену1 та аніони кислотного залишку: Як уже згадувалось, багатоосновні кислоти дисоціюють ступінчасто. Основність кислоти визначається […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Назви карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти Якщо до карбонільної групи приєднана гідроксильна група, то в результаті отримуємо карбоксильну групу – функціональну групу карбонових кислот. Увага: карбонатна кислота належить до неорганічних кислот, хоча вона теж є сполукою Карбону. 5.1 . Назви карбонових кислот Карбонові кислоти мають свій гомологічний ряд. Назви одноосновних карбонових кислот утворюють від […]...
- КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ І ОСНОВИ Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке: Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ЛАБОРАТОРНИЙ ДОСЛІД 6 Випробування водних розчинів кислот і лугів індикаторами Речовини та обладнання: пробірки, штатив для пробірок, вода, натрій гідроксид, станова кислота, індикатори. Завдання 1. Користуючись індикаторами, перевіримо, як змінюються їх кольори у воді, водних розчинах кислоти і лугу. Для цього налили в першу пробірку 1 мл води, у другу […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Таблиця розчинності кислот, основ та солей у воді ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 3 Таблиця розчинності кислот, основ та солей у воді...
- Назви найважливіших кислот ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ ДОДАТОК 4. Назви найважливіших кислот Борна (ортоборатна) кислота Н3ВО3 Бромідна кислота НВr Дихроматна кислота Н2Сr2О7 Іодидна кислота Нl Карбонатна кислота Н2СО3 Манганатна(VІІ) кислота НМnO4 Нітратна кислота HNO3 Нітритна кислота HNO2 Ортофосфатна кислота Н3РО4 Силікатна кислота Н2SіО3 Сульфатна кислота H2SO4 Сульфідна кислота H2S Фторидна (плавикова) кислота HF […]...
- Кислоти, їх склад і назви. Класифікація кислот Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 13 Тема. Кислоти, їх склад і назви. Класифікація кислот Цілі уроку: розширити знання про класифікацію неорганічних речовин на прикладі кислот; ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот. Тип уроку: поглиблення знань, вивчення нового матеріалу. Форми роботи: робота з опорною схемою, розповідь учителя, демонстраційний експеримент. Обладнання: Періодична […]...
- Кислотні властивості – Властивості карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.3. Властивості карбонових кислот Кислотні властивості Карбонові кислоти – кислоти середньої сили. їхня сила – тобто здатність карбоксильної групи відщеплювати протон – визначається індуктивним ефектом, який викликається угрупованням, пов’язаним з карбоксильною групою. Карбонові ланцюги викликають +І-ефект, сила якого залежить від довжини карбонового ланцюга. Запам’ятайте: чим довший карбоновий ланцюг, […]...
- Загальні способи одержання оксидів, основ, кислот, солей Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 34 Тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук. Тип […]...
- Тема 13. Кислоти – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Тема 13. Кислоти Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть кислоту, що може утворювати кислі солі: A. Карбонатна кислота; Б. Нітратна кислота; B. Оцтова кислота; Г. Хлоридна кислота. 2. Вкажіть ряд кислот, в якому […]...
- Нуклеїнові кислоти. Склад нуклеїнових кислот. Будова подвійної спіралі ДНК. Біологічна роль нуклеїнових кислот II Семестр Тема 5. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 56 Тема уроку. Нуклеїнові кислоти. Склад нуклеїнових кислот. Будова подвійної спіралі ДНК. Біологічна роль нуклеїнових кислот Цілі уроку: формувати в учнів знання про нуклеїнові кислоти як найважливіші сполуки, що зумовлюють існування всіх живих організмів; ознайомити учнів зі складом і будовою нуклеїнових кислот; формувати уявлення про матеріальну єдність […]...
- Розчинність кислот, основ та солей у воді – ХІМІЯ Формули й таблиці ХІМІЯ Розчинність кислот, основ та солей у воді H+ NH4+ Na+ K+ Ва2+ Са2+ Mg2+ Аl3+ Сr3+ Fe3+ Fe2+ Мn2+ Zn2+ Ag+ Hg22+ Hg2+ Сu2+ Рb2+ Ві3+ Sn2+ F- Р Р Р Р М Н Н Р Р Р М М М Р Н М Н Н Н Р Cl- Р Р […]...
- Солі сульфатної кислоти – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.8. Солі сульфатної кислоти Сульфатна кислота, як двохосновна, утворює два ряди солей: середні, що називаються сульфатами, і кислі, що називаються гідросульфатами. Сульфати утворюються при повній нейтралізації кислоти лугом (на один моль кислоти припадає два молі лугу), а […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Фізичні властивості карбонових кислот Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ КАРБОНОВІ КИСЛОТИ Фізичні властивості карбонових Кислот На відміну від альдегідів, уже перший член ряду – мурашина кислота – рідина з досить високою температурою кипіння, початкові члени ряду мають різкий запах, пропіонова має запах поту, запах масляної кислоти відчувається при підгоранні їжі […]...
- Розв’язування типових задач Оксиди, кислоти, основи, солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.7. Розв’язування типових задач Оксиди, кислоти, основи, солі Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення; CuSO4 -> Сu -> СuО -> СuСl2 -> Сu(OН)2 -> Cu(OH)NO3 -> Сu(NO3)2. Розв’язання. 1) […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Тема 3 ВОДА & 36. ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Вивчення параграфа допоможе вам: · наводити приклади формул кислот і основ; · складати рівняння реакцій води з деякими оксидами; · розпізнавати дослідним шляхом кислоти і луги Вода вступає в хімічні реакції з багатьма речовинами. Розглянемо, як вона взаємодіє з оксидами та […]...
- Електрохімічний ряд напруг при 25 °С – Показники рК кисл. і рК осн. при 25 °С ДОДАТОК 5 . Показники рКкисл. і рКосн. при 25 °С РКкисл. Сполучена кислота Сполучена основа РКосн. Повний протоліз Хлорна кислота НСlO4 СlO4- Перхлороат-іон Протеолізу немає Хлоридна кислота HCl Cl- Хлорид-іон Нітратна кислота HNO3 NO3- Нітрат-іон Сульфатна кислота H2SO4 HSO4- Гідросульфат-іон -1,74 Гідроксонію-іон H3O+ Н2O Вода 15,74 1,92 Сульфітна кислота SO2+2H2O HSO3- Гідросульфіт-іон 12,08 1,92 Гідросульфат-іон […]...
- Основи, їх склад і назви. Класифікація основ Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 15 Тема. Основи, їх склад і назви. Класифікація основ Цілі уроку: розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ; розвивати вміння й навички складати формули неорганічних сполук за валентністю на прикладі основ, складати назви речовин за сучасною українською номенклатурою, розпізнавати класи неорганічних речовин. Тип уроку: […]...
- Нуклеїнові кислоти. Біологічна роль нуклеїнових кислот Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 58 Тема уроку. Нуклеїнові кислоти. Біологічна роль нуклеїнових кислот Цілі уроку: формувати знання учнів про нуклеїнові кислоти як найважливіші сполуки, що зумовлюють існування всіх живих організмів; ознайомити учнів зі складом і будовою нуклеїнових кислот; формувати уявлення про матеріальну єдність світу, діалектичні уявлення про організацію речовини від простої до складної […]...
- Насичені монокарбонові кислоти – Карбонові кислоти – Оксигеновмісні органічні сполуки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 12. Оксигеновмісні органічні сполуки 12.4. Карбонові кислоти Карбонові кислоти – це похідні вуглеводнів, до складу молекул яких входять одна або декілька карбоксильних груп – СООН. Класифікація карбонових кислот Розрізняють: 1) залежно від кількості карбоксильних груп (основності): – монокарбонові (однооснбвні): НСООН мурашина (метанова) кислота […]...
- Практична робота 2. Властивості етанової кислоти II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 40 Тема уроку. Практична робота 2. Властивості етанової кислоти Цілі уроку: продовжити формування навичок роботи з хімічними речовинами й лабораторним устаткуванням; перевірити знання техніки безпеки під час роботи в кабінеті хімії; поглибити знання учнів про хімічні властивості карбонових кислот на прикладі оцтової кислоти; визначити рівень засвоєння знань […]...
- Тема 40. Карбонові кислоти Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОРГАНІЧНА ХІМІЯ Тема 40. Карбонові кислоти Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Укажіть речовину, за допомогою якої можна визначити оцтову кислоту у розчині: A. Калій гідроксид; Б. Аргентум оксид; B. Лакмус; Г. Фенолфталеїн. 2. Укажіть речовину, яка необхідна […]...