Спектри випромінювання атомів і молекул
2-й семестр
АТОМНА І ЯДЕРНА ФІЗИКА
УРОК 2/79
Тема. Спектри випромінювання атомів і молекул
Мета уроку: ознайомити учнів з лінійчастими й молекулярними спектрами випромінювання.
Тип уроку: урок вивчення нового матеріалу.
ПЛАН УРОКУ
Контроль знань | 4 хв. | 1. Ядерна модель атома. 2. Недоліки ядерної моделі атома. 3. Квантові постулати Бора. |
Демонстрації | 6 хв. | Відео-фрагменти фільму “Спектральний аналіз”. |
Вивчення | 25 хв. | 1. Лінійчасті спектри випромінювання газів. 2. Молекулярні спектри випромінювання. 3. Лінійчасті спектри й енергетичні рівні. |
Закріплення вивченого матеріалу | 10 хв. | 1. Якісні питання. 2. Навчаємося розв’язувати задачі. |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Лінійчасті спектри випромінювання газів
Численні дослідження довели, що внаслідок нагрівання до високої температури пари будь-якої хімічної речовини випромінюють світло, вузький пучок якого призма розкладає на кілька пучків.
O Лінійчасті спектри
Лінійчастий спектр випущення будь-якого конкретного хімічного елемента не збігається зі спектром випущення інших хімічних елементів і, відповідно, є “візитною карткою” елемента.
Відбувається й зворотне явище: у випадку пропускання білого світла через пару речовини спостерігається виникнення темних ліній на тлі суцільного спектра. Темні лінії розташовані точно в тих місцях, де спостерігають лінії спектра випускання цього хімічного елемента. Такий спектр називається лінійчастим спектром поглинання.
2. Молекулярні спектри випромінювання
Спектр молекули складається з великої кількості окремих ліній, що зливаються в смуги, чіткі з одного краю й розмиті з іншого. На відміну від лінійчастих спектрів, смугасті спектри створюють не атоми, а молекули, не зв’язані або слабко зв’язані одна з одною. Серії дуже близьких ліній групуються на окремих ділянках спектра й заповнюють цілі смуги.
3. Лінійчасті спектри й енергетичні рівні
Дослідження лінійчастих спектрів атомів дало багату інформацію про їхні енергетичні рівні. Чим більша різниця енергій стаціонарних станів, тим більша частота випромінювання, що відповідає переходам між цими станами. Розглянемо переходи в атомі Гідрогену.
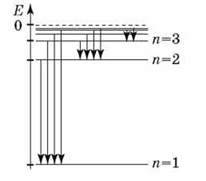
Всі переходи між основним станом і будь-яким іншим відповідають ультрафіолетовому випромінюванню. Всі переходи між першим та іншими збудженими станами відповідають видимому світлу, а всі переходи, що залишилися, – інфрачервоному випромінюванню.
Відстані між “глибокими” енергетичними рівнями важких атомів настільки значні, що переходи між цими рівнями супроводжуються випущенням або поглинанням фотонів рентгенівського випромінювання.
Якщо внаслідок зіткнення зі швидким електроном відбудеться іонізація атома й “звільниться місце”, на якомусь із нижніх енергетичних рівнів, тоді спостерігатимуться переходи “зверху” на цей рівень і виникне рентгенівське випромінювання з лінійчастим спектром (на відміну від гальмового випромінювання, що має безперервний спектр).
Під час випускання світла атом може переходити з будь-якого стану в незбуджений відразу, наприклад, E5 – E1 = hv5,1, або послідовно, через проміжні стани:
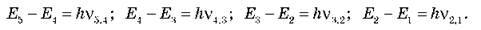
Всі ці переходи здійснюються відповідно до закону збереження й перетворення енергії:
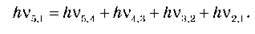
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Якісні питання
1. Чим відрізняється атом, що перебуває в стаціонарному стані, від атома в збудженому стані?
2. Електрон в атомі Гідрогену перейшов із четвертого енергетичного рівня на другий. Як при цьому змінилася енергія атома? Чому?
2). Навчаємося розв’язувати задачі
1. Визначте, який з переходів (див. рисунок а) відповідає: а) випромінюванню з найбільшою довжиною хвилі? б) поглинанню з найбільшою частотою?
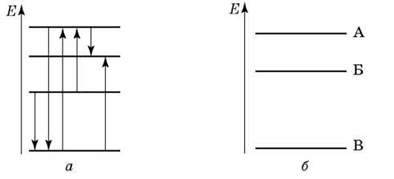
2. На рисунку б показані три енергетичних рівні атома. Під час переходу з рівня А на рівень Б виникає інфрачервоне випромінювання довжиною хвилі 1,2 мкм; під час переходу з рівня Б на рівень В – світло довжиною хвилі 600 нм. Визначте довжину хвилі випромінювання, що виникає в разі переходу атома з рівня А на рівень В.
Домашнє завдання
1. Підр-1: § 51; підр-2: § 25 (п. 3).
2. Зб.: № 16.5; 16.6; 16.7; 16.8.
