Сполуки Фосфору
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ
§ 40. Сполуки Фосфору
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати будову молекул, фізичні та хімічні властивості фосфор(V) оксиду, ортофосфатної кислоти та ортофосфатів, їх застосування;
Складати рівняння реакцій у повній та скороченій йонних формах; пояснювати екологічні проблеми, пов’язані з використанням орто-фосфатів.
Фосфор утворює оксигеновмісні сполуки: фосфор(V) оксид Р2О5, ортофосфатну кислоту Н3РО4, ортофосфати, наприклад
Фосфор(V) оксид Р2О5. Ви вже знаєте, що цей оксид утворюється у вигляді білого диму при горінні фосфору в кисні, а потім осідає на стінках посудини як білий порошок. У паровій фазі цей оксид існує у вигляді димера Р4 О10, молекула якого утворена чотирма тетраедрами [PO4], кожний з яких сполучений з трьома сусідніми через атом Оксигену (мал. 62, а ).
Хімічні зв’язки між атомами в молекулі – ковалентні полярні, кристалічна гратка – молекулярна. За звичайних умов більш стійкою
Як видно зі структурної формули і моделі, кожний атом Фосфору оточують чотири атоми Оксигену.
Фізичні властивості. Фосфор(V) оксид – біла дрібнокристалічна речовина з молекулярною кристалічною граткою. Сполука дуже гігроскопічна – енергійно поглинає воду з повітря. При цьому фосфор(V) оксид перетворюється на аморфну масу, тому його зберігають у герметично закритій посудині.
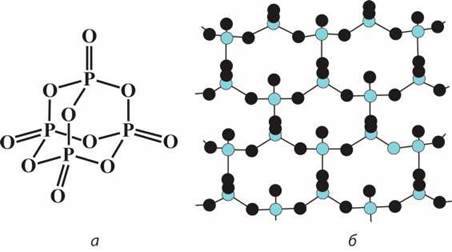
Мал. 62. Молекула Р4О10: а – просторова структура; б – полімерна модифікація
Хімічні властивості. Молекулярна модифікація фосфор(V) оксиду хімічно активна. Полімерна модифікація, навпаки, хімічно не активна, що характерно для більшості сполук з полімерними кристалічними гратками.
Фосфор(V) оксид – кислотний оксид з усіма характерними властивостями (див. § 1). Йому відповідає ортофосфатна кислота Н3РО4.
– Доведіть кислотні властивості фосфор(V) оксиду, склавши відповідні рівняння реакцій у йонних формах.
Особливість фосфор(V) оксиду полягає у його взаємодії з водою. Він здатний зв’язувати із сполук не тільки кристалізаційну, а й хімічно зв’язану воду:
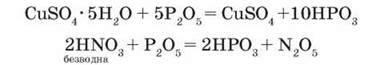
Залежно від температури реакція з водою відбувається по-різному: без нагрівання утворюється метафосфатна кислота НРО3 – отруйна, а при кип’ятінні – ортофосфатна кислота Н3РО4:
Р2О5 + Н2О = 2НРО3; Р2О5 + 3Н2О = 2Н3РО4
Застосування. Фосфор(У) оксид широко використовують як гігроскопічну речовину, наприклад для осушування газів.
– Пригадайте, яку речовину за гігроскопічними властивостями нагадує фосфор(V)оксид.
Ортофосфатна кислота Н3РО4. Речовина молекулярної будови. Подібно до молекули Р4О10 у молекулі Н3РО4 біля атома Фосфору розміщені чотири атоми Оксигену, атоми Гідрогену безпосередньо зв’язані з атомами Оксигену (мал. 63, а, б). Тому при взаємодії ортофосфатної кислоти з металами завжди виділяється водень.
Фізичні властивості. Н3РО4 – безбарвна, тверда кристалічна речовина; добре розчиняється у воді, не отруйна.
Хімічні властивості. Для ортофосфатної кислоти характерні як загальні властивості кислот, так і специфічні.
Загальні властивості. Н3РО4 – трьохосновна кислота, тому дисоціює в три ступені. Це електроліт середньої сили:
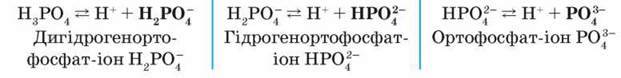
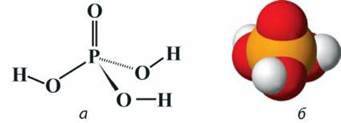
Мал. 63. Молекула Н3РО4: а – структурна формула; б – модель
Найлегше проходить дисоціація за першим ступенем, тому в розчині є переважно йони Н2РО4. Водний розчин кислоти змінює забарвлення індикаторів. Пригадайте, яких і як саме.
Зверніть увагу: якщо ортофосфатна кислота в надлишку, то утворюються кислі солі відповідно до двох видів кислотних залишків – одноза – міщених (дигідрогенортофосфати) і двозаміщених (гідрогенортофосфати):
KOH + H3PO4(надл )= КН2PO4 + H2O;
2КОH + H3PO4(надл )= К2НPO4 + 2H2O,
А якщо кислота не в надлишку, то утворюються середні солі (ортофосфати):
3КOH + H3PO4 = К3PO4 +3H2O
– Складіть рівняння реакцій взаємодії оксидів і гідроксидів кальцію з ортофосфатною кислотою. Виразіть рівняння у йонних формах, дайте назву солям, що утворилися.
Ортофосфатна кислота взаємодіє з розчином амоніаку, утворюючи амоній дигідрогенортофосфат NН4Н2РО4, амоній гідрогенортофосфат (NН4)2НРО4 та амоній ортофосфат (NН4)3 РО4.
– Складіть відповідні рівняння реакцій у йонних формах.
Із солями слабких, летких і нестійких кислот ортофосфатна кислота вступає в реакцію обміну:
2Н3РО4(надл) + 3NаСО3 = 2Nа3РО4 + 3СО2+ 3Н2О
Для ортофосфатної кислоти характерним є те, що вона взаємодіє зі своїми середніми солями, перетворюючи їх на дигідроген – та гідрогенортофосфати:
2Н3РО4 + 3КH2PO4 = 3KH2РO4; Н3РО4 + 2К3PO4 = 3K2HPO4
Специфічні властивості. Під час нагрівання ортофосфатна кислота поступово перетворюється на дифосфатну Н4Р2О7 та метафосфатну
НРО3 кислоти:
2Н3РО4 = Н4Р2О7 + Н2О; Н4Р2О7 = 2НРО3 + Н2О
Застосування. Ортофосфатну кислоту використовують переважно для виробництва фосфатних мінеральних добрив, кормових фосфатів, для очищення металевих поверхонь і створення антикорозійного покриття. Чисту фосфатну кислоту, яку добувають із фосфор(V) оксиду, застосовують у харчовій промисловості як добавку до безалкогольних напоїв.
Ортофосфати – це солі ортофосфатної кислоти з йонною кристалічною граткою. Фосфат-іони РО34- сполучаються між собою (через атом Оксигену) й утворюють полімерні ланцюги (мал. 64), які можуть містити до 106 атомів Фосфору. Із властивостей ортофосфатної кислоти ви дізналися, що вона утворює три види солей: дигідрогенортофосфати, гідрогенортофосфати і ортофосфати.
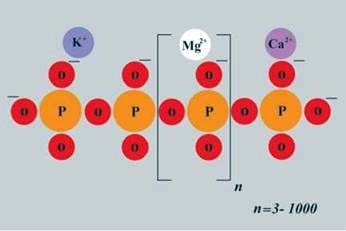
Мал. 64. Схема утворення молекули поліфосфату
Ортофосфати майже всіх металічних елементів у воді нерозчинні (виняток – ортофосфати лужних елементів і амонію), а дигідрогенортофосфати, навпаки, усі добре розчинні. Особливу групу ортофосфатів становлять поліфосфати (мал. 64).
Розчинні у воді ортофосфати виявляють загальні властивості солей. На відміну від нітратів розчинні солі ортофосфатної кислоти підлягають частковому гідролізу як солі сильних основ і кислоти середньої сили з утворенням лужного середовища:
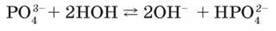
Коротко про головне
До оксигеновмісних сполук Фосфору належать фосфор(V) оксид, ортофосфатна (фосфатна) кислота, ортофосфати. Молекулярна (летка) модифікація фосфор(V) оксиду має склад Р4О10. Існує також полімерна модифікація фосфор(V) оксиду.
Фосфор (V) оксид Р2О5 – кислотний оксид з усіма характерними для цього класу речовин властивостями.
Ортофосфатна кислота Н3РО4 – це електроліт середньої сили, дисоціює в три ступені, виявляє як загальні властивості кислот, так і специфічні. Утворює солі ортофосфати, дигідроге – нортофосфати, гідрогенортофосфати. Існують також поліфосфати як солі полікислот. Вони мають біологічне і промислове значення. Якісною реакцією на ортофосфат-іони РО34- є утворення жовтого осаду аргентум фосфату Ag3PO4 у реакції фосфатної кислоти або фосфатів з розчином аргентум нітрату.
Для допитливих. Фосфати є забруднювачами навколишнього середовища. Потрапляючи у водойми, вони спричиняють бурхливий розвиток водоростей, нестачу кисню і, як наслідок, – загибель риби та інших тварин через задуху. Це можна пояснити нестачею сонячного освітлення, гальмуванням у придонних рослин процесу фотосинтезу, отже, й дефіцитом кисню.
