Сполуки Силіцію(ІV)
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ
§ 51. Сполуки Силіцію(ІV)
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати фізичні та хімічні властивості, способи добування і застосування силіцій(IV) оксиду, силікатної кислоти і силікатів;
Складати рівняння відповідних хімічних реакцій.
Силіцій(ІV) оксид (силіцій діоксид, кремнезем) – стійкий кислотний оксид SiO2 з вищим ступенем окиснення Силіцію +4, який дуже відрізняється за своїми фізичними і хімічними властивостями від аналогічного
84, б). Окремих молекул SiO2 в кристалі немає, увесь кристал являє собою ніби одну гігантську молекулу, або неорганічний полімер (SiO2)n. Тому запис складу силіцій(IV) оксиду у вигляді
Хімічні властивості. Як кислотний оксид SiO2 вступає в хімічні реакції, характерні для цього класу сполук. Але реакційна здатність його низька: на відміну від інших кислотних оксидів силіцій(IV) оксид не реагує з водою, лише за підвищеної температури (при спіканні чи сплавлянні) взаємодіє з основними оксидами, лугами, карбонатами лужних елементів з утворенням солей силікатної кислоти:
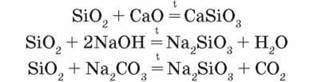

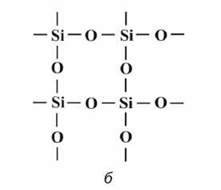
Мал. 84. Кварц (а), кристалічна гратка кварцу (б)
Подібно до карбон діоксиду силіцій(ІV) оксид здатний вступати в окисно-відновні реакції, виявляючи окиснювальні властивості:
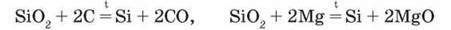
Застосування. Силіцій(ІV) оксид має широке застосування в техніці. Кварцовий пісок іде на виробництво бетону, силікатної цегли, керамічних виробів, кварцового скла, що детальніше розглядатиметься у наступному параграфі. Пластинки з кристалів кварцу здатні перетворювати механічну енергію в електричну. Такі речовини за назвою п’єзоелектрики використовують як генератори звуку. Дрібний порошок силіцій(ІV) оксиду – силікагель – застосовують як адсорбент у фармацевтичній, оптичній, парфумерній, шкіряній промисловості (мал. 85).
Силікатна кислота відповідає кислотному силіцій(ІV) оксиду SіО2. Хімічна формула – Н2SiO3. Атоми Силіцію у кислоті сполучені через атоми Оксигену в ланцюги різної довжини:
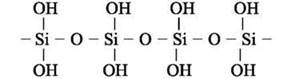
Хімічна формула H2SiO3, як і в силіцій(ІУ) оксиду, є умовною і відображає кількісне співвідношення між атомами в молекулі. Силікатна кислота – це суміш силікатних кислот, які відрізняються довжиною ланцюгів. Виділити окремі кислоти неможливо.
Свіжодобута силікатна кислота має вигляд драглистого осаду (мал. 86), у воді не розчиняється, при нагріванні легко розкладається подібно до карбонатної кислоти:
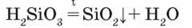
Силікатна кислота як нерозчинна речовина і слабкий електроліт не виявляє багатьох властивостей, характерних для кислот. Так, вона не змінює кольору індикаторів, не реагує з металами, але розчиняється в лугах, утворюючи солі
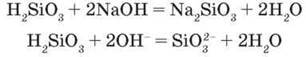

Мал. 85. Силікагель

Мал. 86. Силікатна кислота
:
На відміну від багатьох інших оксигеновмісних неорганічних кислот силікатну кислоту не можна добути розчиненням її оксиду у воді, бо він з нею не реагує. Добувають силікатну кислоту дією сильнішої кислоти на її солі:
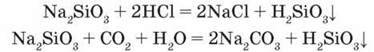
Реакцію розчину солі силікатної кислоти з кислотою використовують як якісну реакцію для виявлення силікатів.
Силікатна кислота не має широкого застосування. З неї добувають силікагель.
Силікати – солі силікатної кислоти. Хімічні формули також є умовним записом їх складу. Нерозчинні у воді силікати входять до складу багатьох гірських порід. Формули прийнято записувати як сукупність формул оксидів, наприклад магній силікат – 2MgO – SiO2, азбест – 3MgO – 2SiO2 – 2H2O. Природні силікати, до складу яких входить алюміній, називаються алюмосилікатами: польовий шпат – К2О – Al2O3 – 6SiO2, глина – Al2O3 – 2SiO2. Розчинними у воді є лише силікати Натрію і Калію. Водний розчин натрій силікату Na2SiO3 відомий як силікатний клей. Цю сіль називають рідким склом за здатність утворювати в’язкі розчини, які поступово перетворюються на склоподібну масу. Розчинні у воді силікати вступають у реакції обміну з кислотами, з іншими солями:
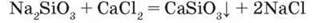
– Чи з усіма солями реагує натрій силікат? Відповідь обгрунтуйте.
У водних розчинах силікати гідролізують і створюють лужне середовище:
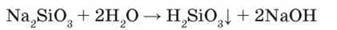
Унаслідок слабкості та нестійкості силікатної кислоти гідроліз перебігає до кінця, тому з часом розчини силікатів мутнішають через утворення нерозчинної силікатної кислоти.
– Поясніть, чому в таблиці розчинності у клітинках, що відповідають силікатам трьохвалентних металічних елементів, стоять риски.
Застосування. Із розчинних силікатів найбільше застосовується натрій силікат. Його водний розчин використовують для просочування деревини та тканин (театральні декорації), щоб надати їм вогнетривкості; виготовлення цементних розчинів; у виробництві силікатних клеїв і фарб, мийних засобів тощо. Калій силікат застосовують у виробництві керамічних і порцелянових виробів. Алюмосилікати широко використовують у силікатній промисловості, а також як адсорбенти.
Коротко про головне
До важливих сполук Силіцію належать силіцій(ІУ) оксид, силікатна кислота та її солі (силікати). Силіцій(ІV) оксид SiO2 – кислотний оксид, основа гірських порід. Має атомну кристалічну гратку, тому тугоплавкий, нерозчинний у воді, малоактивний за стандартних умов. За нагрівання реагує з основними оксидами, лугами, витісняє леткіші оксиди з солей. Використовується у виробництві будівельних матеріалів, кераміки, кварцового скла тощо.
Силікатна кислота H2SiO3 – нерозчинна у воді, нестійка, слабка, не виявляє більшості хімічних властивостей, характерних для кислот. Добувають витісненням сильнішими кислотами з її солей. Застосовують для добування поруватого адсорбенту силікагелю SiO2 з високою поглинальною здатністю.
Силікати, крім силікатів лужних елементів, нерозчинні у воді. Реагують з кислотами, іншими солями, у водних розчинах гідролізують. Природні сполуки руйнуються, утворюючи мінеральні поклади, грунти. Застосовуються у виробництві силікатних матеріалів.
Для допитливих.
Дослід. У посудині змішайте силікатний клей з теплою водою у співвідношенні 1:5. Користуючись трубочкою або соломинкою, продуйте крізь розчин вуглекислий газ. Яка речовина випадає в осад? Напишіть рівняння хімічної реакції.
