Ступінь окиснення
Тема 4
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ
УРОК 61
Тема. Ступінь окиснення
Цілі уроку: сформувати уявлення про ступінь окиснення, розділити поняття “валентність” і “ступінь окиснення”; формувати навички визначення ступеня окиснення в сполуках за формулами, а також за будовою атомів, що утворюють ці сполуки.
Тип уроку: засвоєння нових знань, умінь і навичок.
Форми роботи: розповідь учителя, тренувальні вправи, індивідуальна робота за картками.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
ХІД УРОКУ
І. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Біля дошки троє учнів виконують завдання, одночасно клас працює в зошитах.
Завдання. Визначте вид хімічного зв’язку, тип кристалічних граток у молекулах. Покажіть, до якого атома зміщатимуться електрони в молекулах: НСl, NaCl, Сl2.
Після виконання завдання разом із класом аналізуємо відповіді учнів, показуємо, що у випадку гідроген хлориду спільна електронна пара зміщається до більш електронегативного атома Хлору. Умовно атом Гідрогену віддає
У молекулі натрій хлориду атом Натрію віддає атому Хлору один електрон, у результаті чого вони перетворюються на заряджені частинки – іони, які притягуються один до одного:
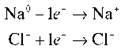
В обох випадках ми говоримо про перерозподіл електронів усередині молекули.
III. Вивчення нового матеріалу
Для характеристики атомів хімічних елементів у сполуках з іонним і ковалентним полярним зв’язком використовують поняття ступеня окиснення.
Ступінь окиснення – це умовний заряд, який отримали б атоми в сполуках у результаті обміну електронами в процесі утворення хімічного зв’язку.
Ступінь окиснення може дорівнювати нулю або виражатися цілим додатним або від’ємним числом.
Ступінь окиснення можна розрахувати виходячи з будови атома певного хімічного елемента або за формулою хімічної речовини.
Розглянемо будову атома Флуору. Зовнішній рівень незавершений. На зовнішньому рівні сім електронів, один неспарений. В атома Флуору найвища електронегативність. Він може лише приєднувати електрони. Отже, після приєднання одного електрона ступінь окиснення Флуору дорівнюватиме -1.
Аналогічно розглядаємо будову атома Оксигену. Характерний ступінь окиснення Оксигену з менш електронегативними елементами дорівнює -2. У сполуці з Флуором він дорівнює +2 (OF2).
Розглянемо деякі правила розрахунку ступенів окиснення. (Учні одержують картку-інструкцію.)
1) Сума ступенів окиснення всіх атомів у молекулі дорівнює нулю.
2) Ступінь окиснення атомів простої речовини дорівнює нулю.
3) Ступінь окиснення атома Флуору в сполуках дорівнює -1.
4) Характерний ступінь окиснення атома Оксигену в складних речовинах дорівнює -2 (винятки OF2, Н2О2).
5) Ступінь окиснення атома Гідрогену в складних речовинах дорівнює + 1 (винятки – гідриди металів, -1).
6) Ступінь окиснення металів у сполуках завжди додатний.
Згадуємо будову атомів елементів I-III періодів (за схемою).
Легко можна помітити, що в металів І групи головної підгрупи ступінь окиснення за кількістю електронів на зовнішньому рівні дорівнює +1. Для металів головної підгрупи другої групи ступінь окиснення дорівнює +2, для металів третьої групи головної підгрупи дорівнює +3.
7) Сума ступенів окиснення атомів у складних іонах дорівнює заряду іона.
IV. Керована практика
Розглянемо ці положення на конкретних прикладах.
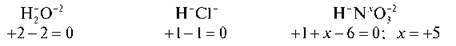
Завдання 1. Учні по ланцюжку біля дошки розраховують ступінь окиснення атомів у записаних на дошці формулах речовин:
СO2, СН4, NH3, N2O5, H2S.
Завдання 2. Індивідуальна робота учнів за картками з визначення ступенів окиснення атомів у речовинах:
Na2O, Сl2O7, NO2, CuO, АlСl3, H2SO4, NaOH, KNO3.
Учитель контролює індивідуальну роботу учнів, коригує помилки, індивідуально консультує учнів.
Потім по ланцюжку учні записують відповіді з метою перевірки, вносять виправлення, за необхідності вчитель ще раз пояснює правила визначення ступенів окиснення на конкретних прикладах.
V. Підбиття підсумків уроку
Учитель обговорює з учнями такі питання:
1. Чому в простих речовинах в атомів ступінь окиснення – нуль?
2. Який знак має ступінь окиснення атома, що притягує електрони?
3. Чому атоми металів виявляють у сполуках лише додатні ступені окиснення?
4. Як визначається ступінь окиснення атомів у складних сполуках?
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, виконати вправи до нього.
