Сульфатна кислота. Фізичні й хімічні властивості
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 13
Тема уроку. Сульфатна кислота. Фізичні й хімічні властивості
Цілі уроку: вивчити фізичні й хімічні властивості сульфатної кислоти, загальні для всіх кислот, на прикладі взаємодії з металами, оксидами, основами, солями; показати відмінності у фізичних і хімічних властивостях концентрованої та розбавленої сульфатних кислот; ознайомити учнів зі специфічними властивостями концентрованої сульфатної кислоти; показати значення сульфатної кислоти.
Тип уроку:
Форми роботи: навчальна лекція, фронтальна робота з опорною схемою, демонстраційний експеримент.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності, ряд активності металів.
Демонстрація 6. Хімічні властивості розбавленого розчину сульфатної кислоти.
Демонстрація 7. Взаємодія концентрованої сульфатної кислоти з міддю.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
1. Аналіз практичної роботи 1, обговорення типових помилок, коригування знань
2. Робота біля дошки
1) Установіть відповідність.
N2O5 H2CO3
SO2 HNO3
CO2 H2SO4
SO3 H2SO3
2) Запишіть рівняння гідратації оксидів із завдання 1.
3) Здійсніть перетворення.
FeS2  SO2
SO2  SO3
SO3  H2SO4
H2SO4
4) Укажіть серед цих реакцій ОВP, у кожній реакції зазначте окисник і відновник.
5) Обчисліть масу сульфатної кислоти, яку можна одержати з 1 т піриту, що містить 10 % домішок, якщо вихід продукту реакції становить 87 %.
III. Вивчення нового матеріалу
1. Фізичні властивості сульфатної кислоти
Безбарвна рідина, важка, дуже гігроскопічна. Поглинає вологу з виділенням великої кількості тепла (79 кДж/моль), утворюючи міцні гідрати. Не можна доливати воду до концентрованої H2SO4: станеться розбризкування внаслідок її нагрівання до температури кипіння. Для розведення H2SO4 її невеликими порціями додають до води (тепло виділяється в товщі води).
Так само “жадібно” H2SO4 поглинає вологу повітря (використовується для осушення).
У продаж надходить 95%-ва сульфатна кислота H2SO4 (? = 1,84 г/мл). Нелетка. Не має запаху. Обвуглює органічні речовини, віднімаючи від них воду (цукор, папір, дерево), тому часто має бурий колір через органічні речовини, що випадково потрапили в неї. Спричиняє сильні опіки!
2. Демонстрація 6. Хімічні властивості розчину сульфатної кислоти
1) Сильний електроліт, у розчині практично повністю дисоціює на іони:
H2SO4 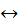 2H+ + SO42-
2H+ + SO42-
2) Утворює два ряди солей: кислі й середні. Які саме з них утворяться, залежить від кількісного співвідношення реагентів:
H2SO4 + NaOH  NaHSO4 + H2O
NaHSO4 + H2O
H2SO4 + 2NaOH  Na2SO4 + 2H2O
Na2SO4 + 2H2O
(демонстрація 2, учні біля дошки складають іонні рівняння реакцій)
3) З основними оксидами:
CuO + H2SO4  CuSO4 + H2O (демонстрація зі складанням іонних рівнянь реакцій)
CuSO4 + H2O (демонстрація зі складанням іонних рівнянь реакцій)
4) Може витісняти більш слабкі кислоти в процесі взаємодії з їхніми солями:
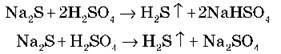
5) З металами розбавлена й концентрована кислоти взаємодіють по-різному: розбавлена реагує з усіма металами до Н2 (крім Рb, тому що PbSO4 не розчиняється):
Fe + H2SO4  FeSO4 + Н2
FeSO4 + Н2
(демонстрація зі складанням іонних рівнянь реакцій)
3. Специфічні властивості концентрованої сульфатної кислоти
1) Концентрована сульфатна кислота не дисоціює на іони.
2) Обвуглювання органічних речовин, що складаються з Карбону й Гідрогену. Якщо цукор змішати з концентрованою H2SO4, маса чорніє й розігрівається й незабаром зі стаканчика починає виповзати пориста чорна маса (за технічної можливості демонструємо дію концентрованої сульфатної кислоти на цукор):
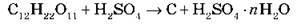
3) Концентрована H2SO4 за кімнатної температури не взаємодіє з деякими металами. Це дозволяє перевозити кислоту (? 75 %) у сталевих цистернах.
4) Під час нагрівання діє майже на всі метали до Ag включно (крім Pt, Au та деяких інших). У цьому випадку водень не виділяється, а утворюються продукти відновлення S+6: SO2, H2S, S, а також сіль і вода. Продукти залежать від активності металу й умов реакції (температура, концентрація H2SO4). Умовно можна прийняти, що сульфатна кислота відновлюється:
– з малоактивними металами – до SO2:
2Ag + 2H2SO4  Ag2SO4 + SO2 + H2O
Ag2SO4 + SO2 + H2O
– у результаті взаємодії з більш активними металами можуть виділятися SO2, H2S і S. Наприклад, узаємодія з Zn (залежно від умов – температури й концентрації):

4. Демонстрація 7. Взаємодія концентрованої сульфатної кислоти з міддю
Реакція в процесі нагрівання протікає поетапно:
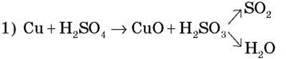
2) Купрум(II) оксид реагує з надлишком сульфатної кислоти, що можна описати рівнянням:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
Сумарне рівняння можна записати так:
Cu + 2H2SO4  CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
5. Значення сульфатної кислоти й сульфатів у народному господарстві
Повідомлення учнів
Застосування H2SO4
Фундамент хімічної промисловості.
Виробництво мінеральних добрив.
Очищення поверхні металів перед нанесенням металевих покриттів.
Очищення нафтопродуктів (у тому числі бензину й гасу). Утворює продукти, нерозчинні в нафтопродуктах.
Виробництво вибухових речовин, мийних засобів, барвників, хімічних волокон.
В акумуляторах.
IV. Первинне застосування отриманих знань
Завдання 1. Як концентрована H2SO4 діятиме на індикатори? Відповідь обгрунтуйте.
Завдання 2. Напишіть рівняння реакцій взаємодії концентрованої сульфатної кислоти з натрієм, цинком, алюмінієм, вуглецем у молекулярній формі й розставте коефіцієнти методом електронного балансу (самостійна робота зі взаємоперевіркою):
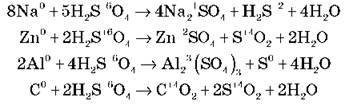
Завдання 3. З перелічених речовин виберіть ті, з якими реагуватиме розбавлена сульфатна кислота. Запишіть рівняння можливих реакцій у молекулярній, повній та скороченій іонній формах.
Ca, Al (OH)3, CuО, ZnO, Cu, CO2, S, K2CO3.
Завдання 4. Обчисліть масу сульфатної кислоти, яку можна одержати зі 100 кг руди, що містить 70 % Сульфуру, якщо масова частка виходу продукту реакції становить 85 %.
V. Підбиття підсумків уроку
Чому розрізняються хімічні властивості розбавленої та концентрованої сульфатної кислоти?
У цистернах з яких металів можна транспортувати концентровану сульфатну кислоту? (Назвіть умови.)
Чому ці самі цистерни не можна використовувати для перевезення розчинів кислоти?
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати повідомлення про сульфати та їх застосування.
