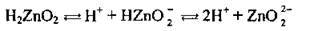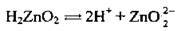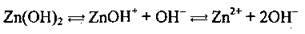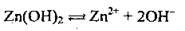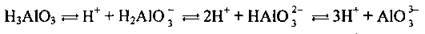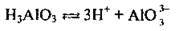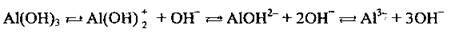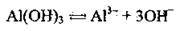Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.7. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації
Згідно з теорією електролітичної дисоціації, кислоти – це сполуки, які дисоціюють на катіони Гідрогену1 та аніони кислотного залишку:
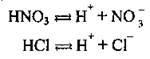
Як уже згадувалось, багатоосновні кислоти дисоціюють ступінчасто. Основність кислоти визначається максимально можливою кількістю йонів Н+, які утворюються
I ступінь: 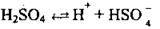
II ступінь: 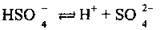
Основи – це сполуки, які дисоціюють на катіони металічних елементів (або йон амонію NH4+) та аніони гідроксилу ОН-:
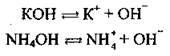
Кислотність основи визначається максимально можливою кількістю гідроксильних груп, які утворюються під час дисоціації формульної одиниці основи.
Солі – це Сполуки, які дисоціюють на катіони металічного елемента (або йон амонію NH4+) та аніони кислотного залишку:
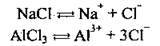
Кислі солі утворюють ще катіони Гідрогену, а основні солі
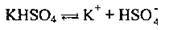
І у незначній мірі
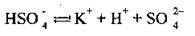
Полярна молекула води дисоціює як амфоліт, тобто одночасно і як кислота, і як основа, на гідроксил ОН – і катіон Гідрогену Н+. Амфолітами є й амфотерні гідроксиди: Zn(OH)2, Аl(ОН)3,Cr(OH)3, Ве(ОН)2, Sn(OH)2.
Дисоціація за обома типами (за типом кислоти і за типом основи) обумовлена тим, що в амфотерних сполуках міцність зв’язків між атомами металічного елемента й Оксигену (Ме-О) і між атомами Оксигену і Гідрогену (О-Н) майже однакова, а тому в розчині ці зв’язки розриваються одночасно. Отже, у розчинах амфотерних гідроксидів наявні незначні кількості Н+ і ОН-.
Ступінчаста дисоціація | Спрощене рівняння | |
Zn(OH)2 |
|
|
|
| |
Аl(ОН)3 |
|
|
|
|
_____________________________________________________
1 Іон Гідрогену (протон) одразу зв’язується з молекулою води, утворюючи йон гідроксонію Н3O+. Однак у рівняннях електролітичної дисоціації спрощено пишуть Н+.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Ступінь електролітичної дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.3. Ступінь електролітичної дисоціації Розчини можуть складатись із частинок розчинника, розчиненої речовини і продуктів їхньої взаємодії, а отже, у розчинах електролітів можуть дисоціювати не всі, а лише частина молекул. Кількісною характеристикою процесу дисоціації є ступінь дисоціації […]...
- Основні положення теорії електролітичної дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.2. Основні положення теорії електролітичної дисоціації 1. Електроліти під час розчинення у воді розпадаються (дисоціюють) на йони. У розчинах чи розплавах електролітів йони рухаються хаотично. 2. Під дією електричного поля (різниці потенціалів) рух йонів набуває спрямованості: […]...
- Теорія електролітичної дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.5. Теорія електролітичної дисоціації Для пояснення особливостей водних розчинів електролітів шведський учений С. Арреніус у 1887 р. запропонував теорію електролітичної дисоціації. Пізніше вона була розвинута багатьма вченими на основі вчення про будову атомів і хімічний […]...
- Механізм дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.6. Механізм дисоціації Суттєвим є питання про механізм електролітичної дисоціації. І дійсно, чому електроліти дисоціюють на іони? Вчення про хімічний зв’язок атомів допомагає відповісти на це запитання. Найлегше дисоціюють речовини з іонним зв’язком. Як відомо, […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Теорія електролітичної дисоціації. Іонні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 3 Тема уроку. Теорія електролітичної дисоціації. Іонні реакції Цілі уроку: актуалізувати знання учнів про процеси, що протікають у розчинах; узагальнити знання про електролітичну дисоціацію речовин; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних рівнянь реакцій. Тип уроку: повторення й систематизації знань. Форми […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Механізми електролітичної дисоціації у водному розчині – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація Залежно від своєї природи речовини по-різному розчиняються у воді. Речовини з атомними кристалічними гратками є надзвичайно стійкими і у воді не розчиняються. Багато речовин з молекулярними кристалічними гратками (з неполярним ковалентним зв’язком) розчиняється у воді, розпадаючись […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Загальні способи одержання оксидів, основ, кислот, солей Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 34 Тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук. Тип […]...
- Розчинність основ і солей у воді ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ ДОДАТОК 2. Розчинність основ і солей у воді Катіони Аніони OH- F- Cl- Br- L- S2- SO2-3 SO2-4 NO-3 PO3-4 CO2-3 SіО2-3 СН3СОО NH+4 – P P P P – P P P P P – P Na+,K+ P P P P P P P P […]...
- Електролітична дисоціація – Розчини Хімія Загальна хімія Розчини Електролітична дисоціація Речовини, розчини або розплави яких проводять електричний струм, називаються електролітамИ. Речовини, розчини або розплави яких не проводять електричного струму, називаються неелектролітамИ. Розпад електролітів на йони під час їхнього розчинення у воді називається електролітичною дисоціацієЮ. Основні положення теорії електролітичної дисоціації 1) Електроліти під час розчинення у воді розпадаються (дисоціюють) на […]...
- Таблиця розчинності кислот, основ та солей у воді ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 3 Таблиця розчинності кислот, основ та солей у воді...
- Чисельне вираження складу розчинів – РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.1. Чисельне вираження складу розчинів У природі й техніці розчини мають величезне значення. Рослини засвоюють речовини у вигляді розчинів. Засвоєння їжі пов’язане з переходом поживних речовин у розчин. Усі природні води є розчинами. Розчинами є […]...
- Розвиток понять “кислоти” й “основи” – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості: – кислий смак; – розчиняють неблагородні метали, виділяючи водень; – розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду; – змінюють забарвлення індикаторів. До основ відносяться речовини, водні розчини яких (луги) мають такі властивості: – мильні на дотик; […]...
- Хімічні властивості карбонових кислот Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ КАРБОНОВІ КИСЛОТИ Хімічні властивості карбонових кислот 1. Вплив кислот на індикатори за рахунок дисоціації на іони: 2. Взаємодія з металами: 3. Взаємодія з оксидами металів: 4. Взаємодія з лугами: 5. Горіння: Як і більшість органічних сполук, карбонові кислоти дуже добре горять, […]...
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Теорія Бренстеда – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.2. Теорія Бренстеда Багато речовин утворюють кислі або лужні розчини, але не відповідають наведеним визначенням кислот і лугів. Приклад. Розчин амоній хлориду має кислу реакцію, а розчин натрій ацетату – лужну. У зв’язку з цим Йоганн Бренстед і Томас Лоурі сформулювали в 1923 р. нове визначення кислот […]...
- Розчинність кислот, основ та солей у воді – ХІМІЯ Формули й таблиці ХІМІЯ Розчинність кислот, основ та солей у воді H+ NH4+ Na+ K+ Ва2+ Са2+ Mg2+ Аl3+ Сr3+ Fe3+ Fe2+ Мn2+ Zn2+ Ag+ Hg22+ Hg2+ Сu2+ Рb2+ Ві3+ Sn2+ F- Р Р Р Р М Н Н Р Р Р М М М Р Н М Н Н Н Р Cl- Р Р […]...
- Кислоти й основи, за Льюїсом – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.3. Кислоти й основи, за Льюїсом Визначення, запропоноване Гілбертом Н. Льюїсом, не обмежується розглядом перенесення протонів. Згідно з цим визначенням, кислотами є частинки, атоми яких мають незаповнені валентні оболонки. Кислота – це частинка з незавершеною електронною конфігурацією. Основа є частинкою, яка надає пару електронів для утворення ковалентного […]...
- Індикатори – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Титрування – це кількісний спосіб визначення невідомої концентрації розчину. При титруванні методом нейтралізації шукана концентрація кислоти визначається за допомогою лугу відомої концентрації. Індикатори Для визначення точки еквівалентності необхідний кислотно-основний індикатор. Такий індикатор є найчастіше слабкою кислотою, яка має інше забарвлення, відмінне від відповідної зв’язаної основи. […]...
- Вибір індикатора – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Вибір індикатора Для визначення точки еквівалентності при титруванні потрібно мати відповідний індикатор, зміна кольору якого відбувається в межах області значень pH, в якій крива титрування проходить вертикально. Запам’ятайте: – Крива титрування сильних лугів сильними кислотами має велику (область значень pH по вертикалі. Для визначення точки […]...
- Гідроліз солей – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.5. Гідроліз солей Означення. Досвід показує, що розчини середніх солей мають лужну, кислу або нейтральну реакцію, хоча вони і не містять ні водневих, ні гідроксильних іонів. Пояснення цьому факту слід шукати у взаємодії солей з […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Проведення титрування – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Проведення титрування Для визначення концентрації кислоти або лугу потрібне таке приладдя: – піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації; – бюретка для вимірювання розчину відомої концентрації; – Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації. Після додавання […]...
- Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.11. Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів У хімії часто стикаються з явищем гідролізу1 – хімічної взаємодії речовин з водою. Найбільше практичне значення має гідроліз солей. Гідроліз солей – це хімічна взаємодія солей […]...
- Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та […]...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...
- Електроліти та електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електроліти та електролітична дисоціація Усі речовини можна розділити на електроліти та неелектроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Розчини й розплави неелектролітів електричний струм не проводять. До електролітів відносять речовини з іонною будовою, а також речовини […]...
- Ступінь дисоціації. Сильні та слабкі електроліти Тема 1 РОЗЧИНИ Урок 13 Тема уроку. Ступінь дисоціації. Сильні та слабкі електроліти Цілі уроку: розширити знання учнів про електроліти; ознайомити з поняттями “сильні та слабкі електроліти”; показати кількісну характеристику процесу електролітичної дисоціації – ступінь дисоціації; закріпити навички складання рівнянь дисоціації кислот, основ і солей; визначити відмінності сильних і слабких електролітів. Тип уроку: комбінований урок […]...
- Кислотні властивості – Властивості карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.3. Властивості карбонових кислот Кислотні властивості Карбонові кислоти – кислоти середньої сили. їхня сила – тобто здатність карбоксильної групи відщеплювати протон – визначається індуктивним ефектом, який викликається угрупованням, пов’язаним з карбоксильною групою. Карбонові ланцюги викликають +І-ефект, сила якого залежить від довжини карбонового ланцюга. Запам’ятайте: чим довший карбоновий ланцюг, […]...
- Константа дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.4. Константа дисоціації Як уже згадувалось, дисоціація – процес оборотний: паралельно з розщепленням молекул на йони відбуваються процеси сполучення йонів у молекули – асоціація. Під час дисоціації слабких електролітів, наприклад нітритної кислоти, у певний момент встановлюється […]...
- Проміжне оцінювання з теми “Фізичні й хімічні властивості оксидів і кислот” Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 21 Тема. Проміжне оцінювання з теми “Фізичні й хімічні властивості оксидів і кислот” Цілі уроку: узагальнити й систематизувати знання учнів про класифікацію неорганічних сполук, фізичні й хімічні властивості оксидів і кислот; визначити рівень навчальних досягнень учнів з цієї теми. Тип уроку: контроль і коригування знань. Форми роботи: письмова […]...
- Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 19 Тема. Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Цілі уроку: закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти; поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот; розвивати навички експериментальної роботи з […]...
- Агрегатний стан, розчинність – Властивості карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.3. Властивості карбонових кислот Перші представники карбонових кислот (С1-С3) мають різкий специфічний запах, зі збільшенням вуглеводневого радикала (С4-С9) неприємний запах зникає. Агрегатний стан, розчинність Фізичні властивості пов’язані з полярністю карбоксильної групи. Полярність обумовлює утворення водневих зв’язків з молекулами води або іншими молекулами карбонових кислот. – Нижчі члени гомологічного […]...