Водневий зв’язок – Типи хімічного зв’язку
ХІМІЧНИЙ ЗВ’ ЯЗОК
2. Типи хімічного зв’язку
2.4 . Водневий зв’язок
У молекулах атоми Гідрогену крім електронної пари не мають інших електронів. Ядро атома Гідрогену (протон) дуже мале, тому густина позитивного заряду дуже велика. Якщо атоми Гідрогену утворюють молекули з найбільш електронегативними атомами, то зв’язуюча електронна пара значно відтягнута від протонів. Тому на зовнішнє оточення вони діють своїм сильним позитивним зарядом. Ці заряди однієї молекули можуть взаємодіяти з негативними зарядами інших молекул,
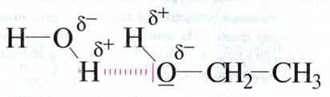
Молекули, які можуть утворювати водневі зв’язки, є постійними диполями.
Водневі зв’язки базуються на взаємодії двох диполів. Вони значно сильніші, ніж вандерваальсова взаємодія.
Молекули, між якими існують водневі зв’язки, в рідкій фазі об’єднуються у великі утворення. Тому, відповідні речовини мають значно більшу температуру кипіння, ніж речовини з такою самою молярною масою.
Приклад. Фтористий метан і метанол
CH3 – F | CH3 – OH | |
Молярна маса | 34 а. о. м. | 32 а. о. м. |
Температура кипіння | -78 °С | +65 °С |
Особливо великий вплив має водневий зв’язок на властивості води. Це є наслідком того, що в кожній молекулі води є два протони, які можуть брати участь в утворенні двох водневих зв’язків.
У твердому стані (лід) молекули води утворюють структуру, в якій кожен атом Оксигену зв’язаний містками через атоми Гідрогену з чотирма сусідніми атомами Оксигену, утворюючи тетраедр.
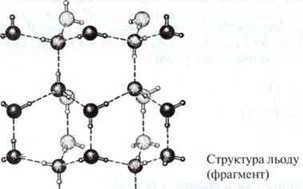
Цим пояснюється міцність кристалічної гратки й незвично висока температура плавлення води.
І в рідкому стані молекули води сполучені між собою водневими зв’язками. Щоб відірвати їх одна від одної, потрібна порівняно велика енергія. Цим пояснюється надзвичайно висока температура кипіння води.
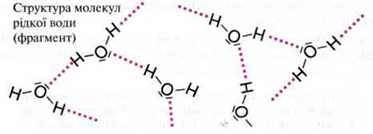
Розчинність у воді деяких молекулярних речовин пояснюється їх здатністю утворювати водневі зв’язки.
При цьому діє правило:
“подібне розчиняється у подібному”, тобто полярне розчиняє полярне, неполярне розчиняє неполярне.
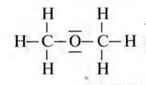
Речовини, молекули яких мають лише вільні пари електронів, але не мають протонованих атомів Гідрогену, не можуть утворювати водневі зв’язки. Без протонованих атомів Гідрогену взаємодія між диполями неможлива.
Приклад. Диметиловий етер має лише вільні пари електронів атома Гідрогену. Етер має низьку температуру кипіння і не розчиняється у воді.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Водневий зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.3. Водневий зв’язок Низка сполук з полярним Ковалейтним зв’язком, які містять Гідроген і елемент з високою електронегативністю (найчастіше Оксиген, Флуор, Нітроген), утворюють так званий водневий зв’язок (позначають “—“). Це різновид невалентного міжмолекулярного зв’язку (вандерваальсового1), […]...
- Будова молекули води. Водневий зв’язок між молекулами води ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.4. Будова молекули води. Водневий зв’язок між молекулами води У молекулі води є два ковалентні полярні зв’язки між атомом Оксигену і двома атомами Гідрогену. Через велику різницю електронегативності Оксигену (3,5) і Гідрогену (2,2) електронні хмари зміщені в бік Оксигену, […]...
- Водневий зв’язок Хімія Загальна хімія Хімічний зв’язок Водневий зв’язок Водневий зв’язок – це зв’язок між позитивно зарядженим атомом Гідрогену однієї молекули і негативно зарядженим атомом іншої молекули. Водневий зв’язок має частково електростатичний, частково донорно-акцепторний характер....
- Гібридизація орбіталей – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Гібридизація орбіталей Виходячи з конфігурації електронів, атом Карбону мав би бути двовалентним, утворюючи зв’язки в результаті перекривання двох напівзайнятих 2р-орбіталей з орбіталями інших атомів. Проте це не так: – Карбон у своїх сполуках найчастіше є чотиривалентним. – У молекулі метану є чотири ідентичні зв’язки, які […]...
- Вправа 89-94 № 89. Коефіцієнт – цифра перед хімічною формулою, позначає кількість молекул речовини. 2O2 – дві молекули кисню; 3Сu – три атоми міді. Індекс – маленька цифра, записана нижче і справа від символу елементу. Показує кількість атомів елементів, які входять до складу молекули. Н2O – молекула води складається з 2 атомів Гідрогену і одного атому Оксигену. […]...
- Властивості етерів – Етери КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 3. Спирти, феноли й етери 3.3 . Етери Молекули етерів містять два вуглеводневі залишки, що сполучені між собою атомом Оксигену. За номенклатурою IUPAC, етери, в яких вуглеводневі залишки – алкільні замісники, то їх розглядають як похідні алканів і називають алкілоксиалканами. Формально етери в даному випадку розглядаються як похідні спиртів, у яких атом […]...
- Вандерваальсова взаємодія (сила) – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.5 . Вандерваальсова взаємодія (сила)1 Водневі зв’язки обумовлені постійною наявністю диполів, вандерваальсові сили виникають при взаємодії короткочасно утворених диполів. Вандерваальсовий зв’язок – найслабший з усіх типів зв’язку. Короткочасний асиметричний розподіл зарядів є тимчасовим диполем. Цей диполь може поляризувати сусідні молекули і тим самим індукувати (лат. inducere – вводити) […]...
- Кратні зв’язки – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Формування ковалентного зв’язку відбувається також за правилом октету. Атоми з’єднуються в молекули і при цьому намагаються шляхом утворення спільних електронних пар сформувати стійку конфігурацію інертного газу. Розрізняють два випадки утворення ковалентного зв’язку: – кожен атом віддає один електрон для спільної електронної пари; – один атом […]...
- Умови виникнення хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Умови виникнення хімічного зв’язку Хімічний зв’язок – це взаємодія атомів, здійснювана шляхом обміну електронами або їхнім переходом від одного атома до іншого. Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів та перекриванні їхніх […]...
- Хімічні формули речовин № 1. Хімічна формула – це умовний запис складу речовини за допомогою символів хімічних елементів та індексів. За допомогою хімічних формул записують склад речовин. № 2. Індекс показує число атомів в молекулі. Індекс записується маленькою цифрою праворуч від символа елемента. № 3,4. Для речовин молекулярної будови хімічна формула відображає склад молекули речовини, а для речовин […]...
- Рівняння хімічних реакцій. Закон збереження маси речовин у хімічних реакціях Контрольні запитання № 1. Маси речовин, що вступають у реакцію, дорівнюють масі утворених речовин, про що свідчить закон збереження маси в хімічних реакціях. Цей закон підкріплений тим, що атоми в хімічних реакціях не зникають, а просто переходять з одних речовин до складу інших. За допомогою хімічних символів і знаків закон збереження маси відображають рівнянням хімічної […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- Йонний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.1. Йонний зв’язок Якщо різниця електронегативностей пари атомів, що утворюють зв’язок, > 1,7 (за Полінгом), між ними утворюється йонний зв’язок. Зазвичай йонний зв’язок утворюється між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони […]...
- Валентність Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Валентність При утворенні молекули атоми не просто об’єднуються в якийсь безладний клубок, а зв’язуються в певній послідовності особливими хімічними зв’язками. Причому кожен атом може утворити не нескінченне, а тільки певне число таких зв’язків. У XIX столітті вчені встановили, […]...
- Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку Полярність ковалентного зв’язку У молекулах водню, фтору й фтороводню між атомами утворюється ковалентний зв’язок за рахунок утворення спільної електронної пари. Атоми різних хімічних елементів здатні притягувати валентні електрони інших атомів. […]...
- Фізичні властивості спиртів – СПИРТИ Й ФЕНОЛИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ СПИРТИ Й ФЕНОЛИ Фізичні властивості спиртів У гомологічному ряді спиртів немає газоподібних речовин. Перші члени гомологічного ряду – це рідини, а вищі спирти (від С15) – тверді речовини. У гомологічному ряді нормальних спиртів зі збільшенням молекулярної маси збільшуються температури плавлення й […]...
- Фізичні властивості альдегідів – АЛЬДЕГІДИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛЬДЕГІДИ Фізичні властивості альдегідів Альдегіди – безбарвні речовини, з характерним запахом. Перший член гомологічного ряду альдегідів – формальдегід – при звичайних умовах є газоподібною речовиною (на відміну від спиртів). Формула Назва ІUРАС Tпл, °C Tкип, °C Розчинність уводі НСНО Метаналь -92 […]...
- Металічний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.2. Металічний зв’язок Слабо електронегативні атоми металів мають велику здатність віддавати електрони і ставати позитивними іонами. Тому вони формують металічні гратки без участі негативних іонів. Валентні електрони, віддані атомами металу, оточують позитивно заряджені іони металу й утримують гратку електростатичними силами. Запам’ятайте: у металічному зв’язку, на відміну від інших […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Типи реакцій в органічній хімії ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 10. Теоретичні основи органічної хімії 10.9. Типи реакцій в органічній хімії 1. За результатами реакції розрізняють: Тип реакції Приклад Що відбувається Заміщення У молекулі вихідної речовини заміщуються окремі атоми Розкладання (крекінг) Розрив зв’язку С-С Відщеплення (елімінування) Відщеплення двох атомів чи груп атомів від […]...
- СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА АТОМА СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Як і чому відбувається сполучення нейтральних атомів? Почнемо пояснення з найпростішого випадку. Нехай на деякій відстані один від одного (наприклад, 0,1нм) знаходяться два протони – два ядра атома Гідрогену. У чому полягатиме їх взаємодія? Звичайно, вони будуть відштовхуватися, тому що заряджені однойменно. […]...
- Іонний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку При утворенні хімічного зв’язку атоми, що беруть участь у ньому, намагаються набути конфігурації інертного газу. Оскільки при цьому задіяні лише оболонки валентних електронів, то для зображення атома використовують так звану формулу Льюїса, в якій зображені лише валентні електрони. Приклад. Зображення електронної будови атома Натрію і атома Хлору та […]...
- Структура молекулярних граток речовин – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Структура молекулярних граток речовин Молекулярні речовини утворюють у твердому агрегатному стані молекулярну гратку. На відміну від іонної гратки між молекулами в молекулярній решітці існують лише слабкі вандерваальсові зв’язки. Запам’ятайте: усі неметали, оксиди неметалів, безводні кислоти й органічні речовини у твердому стані утворюють молекулярну гратку. Через […]...
- Вода – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.3. Вода Вода – оксид гідрогену – одна з найпоширеніших і найважливіших речовин. Поверхня Землі, вкрита водою, у 2,5 раза більша, ніж поверхня суші. Чистої води у природі немає, – вона завжди містить домішки. Добувають чисту воду […]...
- Масова частка елемента (стор. 78) Завдання для засвоєння матеріалу 1. a) NO2, 2. С6Н12О6 – глюкоза C12H22O11 – сахароза Відповідь: масова частка Оксигену більша у формулі глюкози. 3. NH3, Масова частка показує масу атомів елементу в 100 г речовини. Значить, в 100 г речовини знаходиться 18 г атомів Нітрогену, а в 10 г – 1,8 г Нітрогену. Відповідь: […]...
- Геометрична ізомерія – Типи ізомерії ІЗОМЕРІЯ ОРГАНІЧНИХ РЕЧОВИН 2. Типи ізомерії 2.5 . Геометрична ізомерія У карбонових ланцюгах, в яких між атомами Карбону є тільки одинарний зв’язок (С-С), атоми можуть вільно обертатися довкола своєї осі зв’язку. Отже, немає різниці між формами Або між Якщо карбоновий ланцюг з двох або більше атомів Карбону містить подвійний зв’язок, то атоми Карбону біля подвійного […]...
- СУТНІСТЬ ХІМІЧНОГО ПЕРЕТВОРЕННЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ СУТНІСТЬ ХІМІЧНОГО ПЕРЕТВОРЕННЯ Хімія вивчає перетворення речовин, які супроводжуються зміною їх складу і (або) будови. Наприклад: Суть хімічної реакції – перегрупування атомів, яке супроводжується розривом хімічних зв’язків у вихідних речовинах і утворенням хімічних зв’язків у продуктах реакції. Хімічна реакція супроводжується енергетичними змінами, тому що під час […]...
- Металічний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.2. Металічний зв’язок У речовинах, які утворені металічними хімічними елементами, між атомами виникає металічний зв’язок. Як відомо, атоми металів відносно легко віддають валентні електрони, внаслідок чого утворюються позитивно заряджені йони. Такий процес відбувається не […]...
- Дисоціація води. Водневий показник ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.8. Дисоціація води. Водневий показник Хімічно чиста вода дуже слабо проводить електричний струм. Провідність зумовлена дисоціацією: За температури 25 °С ступінь дисоціації води а = 1,8 · 10-9. Оскільки 1 л води (1000 г) містить 55,56 моль речовини, концентрації […]...
- Ізомерія карбонового скелета – Типи ізомерії ІЗОМЕРІЯ ОРГАНІЧНИХ РЕЧОВИН 2. Типи ізомерії Ізомери – речовини, які відрізняються між собою будовою молекул. При цьому розрізняють два типи ізомерії, які у свою чергу поділяються на підтипи. Структурна ізомерія Просторова ізомерія Атоми в ізомерних молекулах сполучені між собою по-різному. – ізомерія карбонового скелета; – ізомерія положення замісника; – ізомерія положення кратного зв’язку; – функціональна […]...
- АТОМИ. ЙОНИ Розділ 1 ФІЗИКА ЯК ПРИРОДНИЧА НАУКА. ПІЗНАННЯ ПРИРОДИ &9. АТОМИ. ЙОНИ Хоча молекули й дуже маленькі частинки, але й вони діляться. Частинки, з яких складаються молекули, називають атомами. Атом – це найдрібніша частинка речовини, яка зберігає властивості самої речовини. Вирішальну роль у розкритті будови атома відіграли досліди, які провів у 1911 р. основоположник ядерної фізики […]...
- Спирти. Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв’язок, його вплив на фізичні властивості спиртів II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 29 Тема уроку. Спирти. Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв’язок, його вплив на фізичні властивості спиртів Цілі уроку: формувати уявлення учнів про розмаїтість органічних речовин на прикладі оксигеновмісних органічних сполук; розширити поняття “функціональна група” на прикладі гідроксильної групи спиртів; формувати знання учнів про […]...
- Основні положення атомно-молекулярного вчення Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні положення атомно-молекулярного вчення 1. Речовини мають дискретну будову. Вони складаються з частинок (структурних елементів речовини) – молекул, атомів або іонів. 2. Частинки речовини (молекули, атоми або іони) перебувають у безперервному русі. 3. Між складовими частинками речовини діють […]...
- Ізомерія – ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 15. ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ § 15.3. Ізомерія Властивості органічних речовин залежать не тільки від їх складу, а й від порядку сполучення атомів у молекулі. Так, склад етилового (винного) спирту та диметилового етеру виражається однією емпіричною формулою С2Н6О, проте властивості їх […]...
- Хімічна структура та хімічна будова – ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК Хімічна структура та хімічна будова Перший постулат Бутлерова. У молекулах речовин існує певний порядок зв’язування атомів, що називається хімічною структурою, або будовою речовини. Кожній індивідуальній речовині відповідає одна-єдина певна хімічна структура. В органічній хімії Карбон завжди перебуває […]...
- Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Тема 1 РОЗЧИНИ Урок 4 Тема уроку. Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Цілі уроку: формувати уявлення учнів про склад розчинів; ознайомити з властивостями води як універсального розчинника; розвивати знання про хімічний зв’язок і будову речовини на прикладі будови молекули води й поняття про […]...
- Фізичні властивості алканів – НАСИЧЕНІ ВУГЛЕВОДНІ. АЛКАНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ НАСИЧЕНІ ВУГЛЕВОДНІ. АЛКАНИ Фізичні властивості алканів Багато фізичних властивостей (температура плавлення й кипіння) гомологів змінюються не лінійно, а “пилкоподібною” залежністю від кількості атомів Карбону, яку ми подаємо у вигляді графіка: При нормальних умовах (0 °С, 1 атм) перші чотири гомологи являють […]...
- Хімічний елемент Хімія Загальна хімія Основні поняття, закони й теорії хімії Хімічний елемент Хімічний елемент – група атомів з однаковим позитивним зарядом ядра. Усі відомі елементи представлені в Періодичній системі хімічних елементів Д. І. МенделєєвА. Їхнє число обмежене, але комбінації цих елементів дають усе різноманіття відомих у даний час речовин (близько 10 млн). Найпоширеніші елементи Всесвіту – […]...
- ВОДЕНЬ У ПРИРОДІ – ВОДЕНЬ Хімія – універсальний довідник ВОДЕНЬ ВОДЕНЬ У ПРИРОДІ За поширенням у Всесвіті Гідроген займає перше місце. На його частку припадає близько 92% всіх атомів (8% складають атоми Гелію, частка всіх інших разом узятих елементів – менше 0,1%). Таким чином, Гідроген – основна складова частина зірок і міжзоряного газу. В умовах зоряних температур (наприклад, температура поверхні […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...