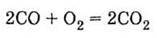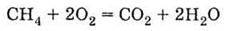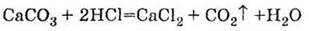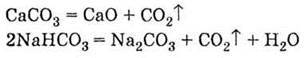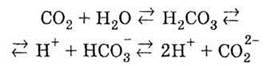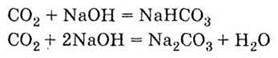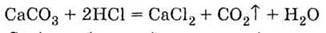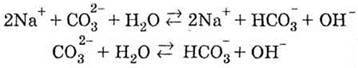ВУГЛЕЦЬ ЯК ПРОСТА РЕЧОВИНА – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ
Хімія – універсальний довідник
ВУГЛЕЦЬ І ЙОГО СПОЛУКИ
ВУГЛЕЦЬ ЯК ПРОСТА РЕЧОВИНА
В атомі Карбону на його зовнішніх чотирьох АО є чотири електрони, тому всі чотири АО беруть участь в утворенні хімічних зв’язків. Цим пояснюється різноманітність і багаточисельність сполук Карбону. Переважна більшість сполук Карбону належить до так званих органічних речовин. У цьому розділі розглядаються властивості неорганічних речовин, утворених Карбоном, – простих речовин, його оксидів, карбонатної кислоти і деяких її солей.
Карбон
В алмазі кожен атом Карбону з’єднаний із чотирма іншими атомами. У просторі ці атоми розташовуються в центрі і кутах тетраедрів, сполучених вершинами. Це – дуже симетрична і міцна гратка. Алмаз – найтвердіша речовина на Землі.
У графіті кожен атом з’єднаний із трьома іншими, які лежать у тій же площині. На утворення цих зв’язків затрачається по три АО з трьома електронами.
Крім електропровідності графіт володіє ще трьома важливими властивостями.
По-перше, тугоплавкість. Температура плавлення графіту вища 3500 °С – це найтугоплавкіша проста речовина на Землі.
Таблиця
Вуглець і його сполуки
Вуглець | Сполуки Карбону | |
Оксид карбону (IV) | Карбонатна кислота | |
1. Має алотропні модифікації: алмаз, графіт, карбін, фулерен та ін. 2. Проявляє відновні властивості: А) горить у кисні:
Неповне згоряння:
Б) взаємодіє з оксидом карбону (IV):
В) відновлює метали з їх оксидів:
Одержання Неповне згоряння метану:
| 1. Газ без запаху, кольору та смаку, важчий за повітря 2. Кислотний оксид 3. При розчиненні взаємодіє з водою:
4. Реагує з основами:
5. Реагує з основними оксидами:
6. Утворюється в реакціях А) горіння вуглецю в кисні:
Б) окиснення оксиду карбону (II):
В) згоряння метану:
Г) взаємодія кислот з карбонатами:
Г) термічного розкладу карбонатів і гідрокарбонатів:
Д) окислювальних біохімічних процесів дихання, гниття | 1. Нестійка молекула. Слабка двохосновна кислота. У водному розчині існує рівновага:
2. Взаємодіє з розчинами лугів як розчин вуглекислого газу у воді 3 утворенням солей – кислих (гідрокарбонатів) і середніх (карбонатів):
3. Витісняється із солей більш сильними | кислотами:
4. Солі карбонатної кислоти піддаються гідролізу:
|
По-друге, відсутність на його поверхні будь-яких продуктів взаємодії з навколишнім середовищем (на металах це оксиди), які збільшують електричний опір.
По-третє, має властивість змащувати поверхні, які труться. У кристалі графіту атоми Карбону міцно з’єднані між собою у плоских сітках, а зв’язок між сітками слабкий: він має міжмолекулярну природу, як і в речовинах з молекулярними гратками, тому навіть незначні механічні зусилля викликають зміщення сіток відносно одна одної, що й зумовлює дію графіту як мастила.
Енергія зв’язку між атомами Карбону у простих і складних речовинах, у тому числі в алмазі і в графіті, дуже велика. Про твердість алмазу вже згадувалося. Міцний зв’язок між атомами і в графітовій сітці. Так, міцність на розрив волокна з графіту значно перевищує міцність заліза і технічної сталі.
На основі графіту виготовляють так звані композиційні матеріали, зокрема карбопластики, в яких волокна графіту знаходяться в матриці з епоксидної смоли. Композиційні матеріали все ширше застосовуються в авіаційній і космічній техніці (адже, крім міцності вони легкі; порівняйте густину графіту, ρ = 2,3 г/см3, з густиною “легкого” алюмінію, ρ = 2,7 г/см3, і, тим паче, заліза, ρ = 7,9 г/см3), а також у кораблебудуванні, де особливо цінні протикорозійні властивості.
Вуглець хімічно інертний тільки при порівняно низьких температурах, а при високих – це один з найсильніших відновників. У хімії, в основному, вуглець застосовують для відновлення металів, насамперед заліза, з руд; у попередньому розділі згадувалося його використання для одержання фосфору.
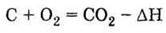
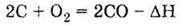
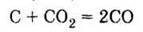
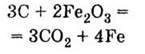
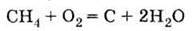
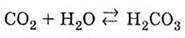
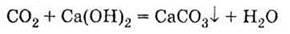
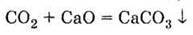
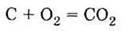 Г
Г