Хімічна рівновага – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ
Хімічна рівновага
Оборотні реакції
Часто напрям реакції залежить від умов її проведення. Наприклад, за звичайних умов переважно відбувається реакція:

Однак при нагріванні до високої температури майже до тисячі градусів, починає переважати зворотна реакція розкладання кальцій карбонату:
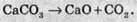
Проте часто трапляється, що перебіг прямої
Реакції, які при заданих умовах відбуваються як у прямому, так і у зворотному напрямках, називають оборотними.
При записі рівнянь таких реакцій замість знаку рівності використовують протилежно спрямовані стрілки:
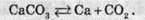
В оборотних реакціях співвідношення кількостей реагентів і продуктів залежить від швидкостей прямої і зворотної реакцій. Якщо швидкість прямої реакції перевищує швидкість зворотної, то в одиницю часу утвориться більше
Оборотні процеси дуже поширені. До них відносяться дисоціація води і слабких кислот, взаємодія водню із бромом, йодом і азотом.
Хімічна рівновага
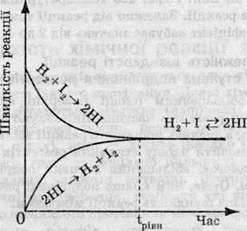
Оборотні реакції ніколи не відбуваються до кінця. Розглянемо взаємодію водню з йодом з утворенням йодоводню. Нехай у початковий момент часу в посудині перебувають лише реагенти – водень та йод – і концентрації їх максимальні. Молекули Н2 і І2 починають взаємодіяти одна з одною – відбувається пряма реакція. Швидкість цієї реакції в початковий момент часу є максимальною і зменшується в міру того, як вихідні речовини витрачаються:
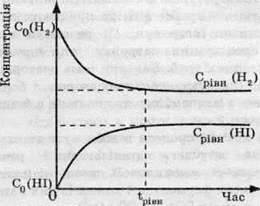
І навпаки, зворотна реакція в початковий момент часу взагалі не відбувається, а зі зростанням концентрації продукту реакції – йодоводню – її швидкість збільшується. Нарешті, в якийсь момент часу швидкості прямої і зворотної реакцій стають рівними, а концентрації реагентів і продукту реакції перестають змінюватися із часом (такі концентрації називають рівноважними). Наступає хімічна рівновага.
Хімічна рівновага – стан, при якому кількості всіх речовин, що беруть участь в оборотній реакції, не змінюються з часом.
У стані рівноваги виникає помилкове враження, начебто в системі нічого не відбувається. Насправді і пряма і зворотна реакції відбуваються одночасно і з однаковими швидкостями: скільки продуктів утворюється в одиницю часу в результаті прямої реакції, стільки ж і витрачається у зворотній. Хімічна рівновага має динамічний характер.
Динамічний характер рівноваги вам може проілюструвати простий приклад. Уявіть собі ріку, по якій проти течії пливе човен. Якщо швидкість човна дорівнює швидкості течії, виникає оманне відчуття, що човен не рухається – його положення щодо берегів буде незмінним.
Склад рівноважної суміші може бути різним залежно від умов. Якщо в суміші більше продуктів, ніж реагентів, то говорять, що рівновага зсунута вправо, у бік продуктів реакції. Якщо ж у суміші переважають реагенти, то вважають, що рівновага зсунута вліво.
Положення рівноваги не залежить від того, з якого боку до нього наближатися: з боку реагентів чи з боку продуктів реакції. Наприклад, рівноважна суміш, отримана нагріванням йодоводню до 450 °С, містить 76% йодоводню за об’ємом. Якщо ж до цієї температури нагріти суміш рівних кількостей водню і йоду, то в рівноважній суміші знову буде 76% йодоводню. Про це свідчить закон діючих мас, згідно з яким відношення добутку рівноважних концентрацій продуктів реакцій до добутку концентрацій реагентів у ступені їх стехіометричних коефіцієнтів є постійним і не залежить від концентрації речовин. Це відношення називають константою хімічної рівноваги. Так, наприклад, для рівноваги синтезу йодоводню математичний вираз для константи рівноваги виявляється наступним:
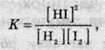
Де квадратними дужками позначаються рівноважні концентрації відповідних речовин.
Вплив концентрації речовин на хімічну рівновагу
Багато промислово важливих реакцій є оборотними. Щоб домагатися високого виходу продуктів, потрібно навчитися управляти рівновагою, зсуваючи її в ту або іншу сторону. Оскільки положення рівноваги визначається швидкостями прямої і зворотної реакцій, то воно залежить від тих самих факторів, що і швидкість, тобто від концентрації речовин і температури. Також на положення рівноваги в реакціях з участю газуватих речовин може впливати і тиск.
Розглянемо суміш, отриману при нагріванні водню і парів йоду до певної температури. За певних умов між воднем, йодом і йодоводнем встановлюється рівновага:
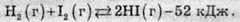
У стані рівноваги швидкості прямої і зворотної реакцій рівні. Якщо в рівноважну суміш додати водень, то швидкість прямої реакції збільшиться, рівновага порушиться і зсунеться вправо. При цьому кількість йодоводню буде зростати доти, доки швидкість його розкладання знову не стане дорівнювати швидкості його утворення, тобто поки не буде досягнуто нового стану рівноваги. Іншими словами, додавання вихідної речовини до рівноважної суміші зсуває рівновагу вправо, тобто у бік продуктів реакції. Навпаки, додавання продукту прискорює зворотну реакцію і зсуває хімічну рівновагу вліво, тобто у бік реагентів.
Вірним є також і зворотне твердження: видалення одного з продуктів реакції зі сфери реакції зсуває рівновагу у бік продуктів, що в підсумку робить процес необоротним. Саме тому виділення речовин з розчину у вигляді осаду або газу є умовою необоротності реакцій іонного обміну.
Цей висновок є окремим випадком загального принципу зсуву рівноваги, що був сформульований французьким фізико-хіміком Анрі Ле Шательє:
Якщо на рівноважну систему зробити зовнішній вплив, то рівновага зсувається у бік ослаблення цього впливу.
Вплив температури середовища на хімічну рівновагу
Відповідно до принципу Лe Шательє, збільшення температури зсуває рівновагу у бік охолодження, тобто підсилює ту реакцію, при якій теплота поглинається. Якщо пряма реакція екзотермічна (Q > 0), то при нагріванні рівновага зсувається вліво (у бік реагентів), а якщо пряма реакція ендотермічна ( Q < 0), то рівновага зсувається вправо (у бік продуктів). Зменшення температури зсуває рівновагу у бік нагрівання, тобто в напрямку екзотермічної реакції.
Реакція розкладання кальцій карбонату є ендотермічною реакцією:
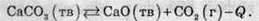
Добування кальцій оксиду (негашеного вапна) з вапняку є поширеною реакцією в промисловості, оскільки негашене вапно є важливою сировиною для виготовлення будівельних матеріалів. Оскільки теплота в результаті цієї реакції поглинається, то для зсуву рівноваги у бік продуктів необхідно температуру підвищувати. Тому розкладання вапняку проводять за високої температури.
Зверніть увагу на те, що вираз “зсув рівноваги у бік тієї або іншої реакції” означає збільшення концентрації продуктів цієї реакції в порівнянні з попереднім станом рівноваги.
Вплив тиску на хімічну рівновагу
Тиск викликає зсув рівноваги тільки в реакціях за участю газуватих речовин і в результаті яких змінюється загальне число молекул газуватих речовин. Збільшення тиску зсуває рівновагу у бік зменшення числа молекул газів, тобто для зменшення тиску в рівноважній системі, а зменшення тиску зсуває рівновагу у бік збільшення числа молекул газів.
Наприклад, в рівнянні реакції синтезу амоніаку число молекул газуватих речовин зменшується (з 4 до 2), тобто в прямій реакції зменшується і тиск в системі:
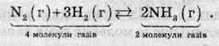
Збільшення тиску зсуває рівновагу у бік зменшення числа молекул газів, тому при підвищенні тиску рівновага зсувається у бік продукту реакції – амоніаку, тому синтез цієї речовини проводять під дуже високим тиском.
Розкладання карбонатної кислоти, навпаки, відбувається зі збільшенням числа молекул газуватих речовин:
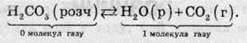
Саме тому при відкриванні пляшки з газованою водою (розчином карбонатної кислоти) тиск всередині пляшки зменшується і це сприяє прямій реакції, в ході якої тиск має збільшитися завдяки виділенню вуглекислого газу. Для приготування газованої води, тобто для отримання розчину карбонатної кислоти, необхідно спрямувати реакцію у зворотний бік. У цій реакції зсув рівноваги у бік карбонатної кислоти відбувається за підвищеного тиску.
В реакції синтезу йодоводню з простих речовин число молекул газуватих речовин не змінюється (до і після реакції по 2):
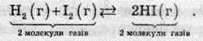
На стан рівноваги таких реакцій зміна тиску не впливає.
Вплив каталізаторів на хімічну рівновагу
При додаванні каталізатора до суміші, що перебуває в стані рівноваги, прискорюються як пряма, так і зворотна реакція, причому швидкості обох реакцій збільшуються однаково. Рівновага при цьому зберігається. Таким чином, каталізатор не зсуває рівновагу, а тільки прискорює її встановлення.
Завдання. Визначте, як впливає збільшення температури і тиску на вихід продуктів у наступних реакціях:
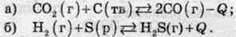
Пряма реакція (а) відбувається з поглинанням теплоти, тому нагрівання сприяє зсуву рівноваги вправо, тобто вихід чадного газу СО збільшується. У ході прямої реакції загальне число молекул газів збільшується: 1 моль СО2 перетворюється в 2 моль СО (вуглець перебуває у твердому стані, тому його не враховують). Отже, збільшення тиску сприяє протіканню зворотної реакції, рівновага зсувається у бік реагентів, і вихід СО зменшується.
Пряма реакція (б) відбувається з виділенням теплоти, тому нагрівання сприяє протіканню зворотної реакції, рівновага зсувається у бік вихідних речовин, і вихід сірководню зменшується. У даній системі число молекул газів не змінюється (сірка перебуває в рідкому стані і не враховується). Отже, тиск не впливає на положення рівноваги і вихід продукту.
