Хімічні властивості алканів
Тема 3
НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ
Урок 36
Тема уроку. Хімічні властивості алканів
Цілі уроку: формувати знання учнів про хімічні властивості алканів; розкрити хімічні властивості алканів, їх реакцію з розчинами кислот, лугів, калій перманганату; показати значення реакцій горіння, повного й часткового окиснення для алканів; розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей алканів.
Тип уроку: вивчення нового матеріалу.
Форми роботи: самостійна робота, розповідь учителя,
Обладнання: моделі молекул вуглеводнів.
Демонстрація 8. Горіння парафінів, визначення якісного складу за продуктами горіння.
Демонстрація 11. Реакція насичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Самостійна робота
Варіант І
1. Дайте назви сполукам:
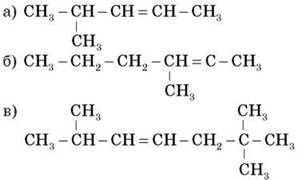
2. Напишіть структурні формули вуглеводнів:
А) 2-метил-2-пентен;
Б) 2,2,5,5-тетраметил-3-гептин.
Варіант ІІ
1.
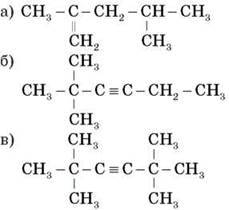
2. Напишіть структурні формули таких вуглеводнів:
А) 2,2,3-триметил-3-гексен;
Б) 2-метил-3-гексин.
2. Перевірка домашнього завдання
1. Запишіть рівняння горіння етану, етену, етину.
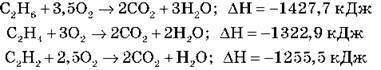
2. Обчисліть і порівняйте об’єми кисню, необхідні для спалювання 5 л етану, етену й етину.
IV. Вивчення нового матеріалу
1. Визначення якісного складу вуглеводнів
Демонстрація 8. Горіння парафінів, визначення якісного складу вуглеводнів за продуктами горіння
1) Окиснення парафіну в присутності купрум(ІІ) оксиду.
2) Як можна довести наявність у продуктах окиснення вуглекислого газу? (Реакція з вапняною водою, яка каламутніє)
3) Як можна довести наявність у продуктах окиснення води? (Безводний купрум(ІІ) сульфат у результаті утворення кристалогідрату змінює забарвлення з білого на блакитний)
4) Запишіть рівняння реакції:
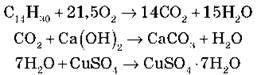
За продуктами горіння можна визначити і якісний, і кількісний склад сполук. Розгляньмо це на прикладі інших вуглеводнів.
2. Хімічні властивості алканів
Складаємо загальну схему, що характеризує хімічні властивості алканів.
1) Горіння:
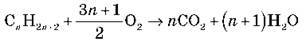
2) Галогенування:
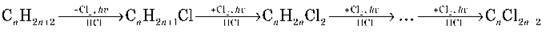
3) Дегідрування (відщеплення H2):

Демонстрація 11. Реакція насичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
1) Одержимо метан з натрій ацетату:
CH3COONa + NaOH 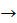 CH4 + Na2CO3
CH4 + Na2CO3
2) Одержаний метан пропустимо крізь розчини хлоридної кислоти, натрій гідроксиду, калій перманганату. Що відбувається?
Висновок: насичені вуглеводні не взаємодіють із розчинами кислот, лугів, калій перманганату.
Одержання алканів
1) Природні джерела (нафта, газ, вугілля)
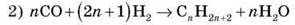
3) Синтез Вюрца (подовження ланцюга)
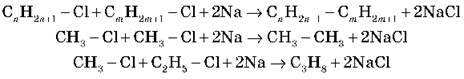
V. Первинне застосування одержаних знань
Тренувальні вправи
1. Використовуючи схеми, що характеризують хімічні властивості алканів, запишіть рівняння реакцій, які характеризують хімічні властивості:
А) етану:
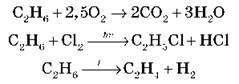
Б) пропану.
2. Алгоритм визначення молекулярної формули (на картці)
1) Визначити молекулярну масу за однією з формул:
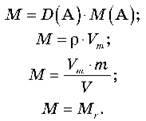
2) Якщо зазначено приналежність до гомологічного ряду:
– записати загальну формулу СnН2n+2;
– M = 12n + 2n + 2;
– обчислити n за відомою М.
3) Якщо дано масові частки елементів у складі речовини, обчислити за формулою масової частки кількість атомів кожного елемента:
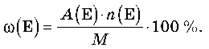
4) За продуктами згоряння із загального рівняння хімічної реакції горіння вуглеводнів:
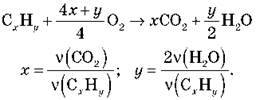
3. Практика на прикладах
Учні виконують два-три індивідуальні завдання в зошиті, учитель консультує.
– Відносна молекулярна маса алкану – 58. Визначте його формулу.
M = 14n + 2 = 58;
N = 4.
C4H10 – бутан.
– 1 л алкану має масу 1,965 г. Визначте його формулу.
M = 22,4 – 1,965 = 44 (г/моль).
14n + 2 = 44;
N = 3.
C3H8 – пропан.
– M(CxHy) = 100.
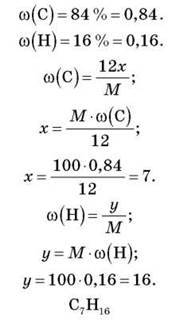
– DH2(CxHy) = 39.
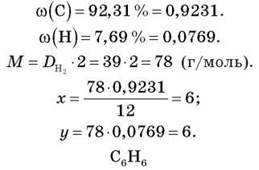
– DH2(CxHy) = 15.
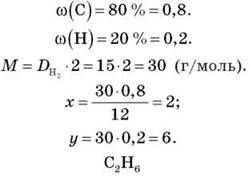
– Dповітря(CxHy) = 4,41 г.

– m(CxHy) = 11,2 г.

– V (CxHy) = 11,2 л.
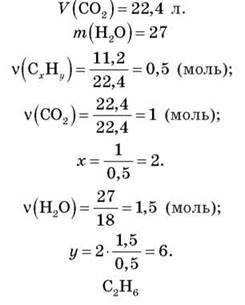
VI. Підбиття підсумків уроку
Який висновок можна зробити про властивості насичених вуглеводнів?
Яке значення має реакція горіння насичених вуглеводнів?
Оцінювання роботи учнів на уроці, оцінювання творчих завдань про застосування етену й етину.
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
