Хімічні властивості кисню. Реакція сполучення. Оксиди
Тема 2 Кисень
& 18. Хімічні властивості кисню. Реакція сполучення. Оксиди
Опанувавши цю тему, ви зможете:
– знати хімічні властивості кисню, реакції сполучення, оксиди;
– розрізняти реакції розкладу та сполучення, процеси горіння, повільного окиснення, дихання;
– складати рівняння реакцій, що характеризують хімічні властивості кисню, взаємодію з простими речовинами;
– пояснювати суть реакцій розкладу та сполучення, горіння й повільного окиснення;
– формувати здатності застосовувати реакції горіння.
–
Хто з вас не спостерігав у повсякденному житті реакцію горіння?
Запаліть сірник, і ви побачите, як горить деревина. Вам, мабуть, не раз у туристичних походах доводилося розводити
Багаття, а вдома декілька разів на день запалювати газ, що використовується як побутове паливо.
Навіщо людство використовує ці реакції? Очевидно, що кожна із згадуваних реакцій горіння супроводжується виділенням тепла та світла.
Горіння – це одна з перших хімічних реакцій, що її освоїла людина з часів добування вогню. Дотепер ця реакція застосовується
Що ж таке реакція горіння? Розглянемо її на прикладах горіння простих і складних речовин.

Рис. 64. Горіння фосфору в кисні
Горіння неметалів у кисні. Вам уже відомо, що під час хімічних реакцій речовини зазнають певних змін. Такі властивості речовин називають хімічними.
Ознайомимося з хімічними властивостями кисню, виконавши демонстраційні досліди.
Дослід 1. Горіння фосфору в кисні (виконується у витяжній шафі). Насипимо в залізну ложечку для спалювання речовин червоний фосфор (рис. 64 а). Нагріємо її в полум’ї так, щоб фосфор загорівся (рис. 64 6). Опустимо горючий фосфор у колбу, попередньо заповнену киснем. Фосфор згоряє яскраво-сліпучим полум’ям з утворенням густого білого диму – фосфор(V) оксиду (рис. 64 в). Згодом дим осяде на стійках колби у вигляді білого порошку (рис. 64 г). Відбулася хімічна реакція
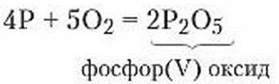
Уважно спостерігаючи що реакцію, помітимо, що вона супроводжувалася зовнішніми проявами, зокрема виділенням світла й теплоти, зміною забарвлення речовини.
Отже, фосфор горить у кисні з утворенням складної речовини фосфор(V) оксиду.
Аналогічно в кисні згоряють прості речовини-неметали сірка, вуглець та інші (рис. 65).
– Складіть самостійно рівняння реакцій вуглецю й сірки з киснем, якщо продуктами є відповідно карбон(ІV) оксид СО2 і сульфур(ІV) оксид SO2. Прочитайте рівняння реакцій.

Рис. 65. Горіння сірки (а) і вуглецю (б) у кисні
Дослід 2. Горіння водню в кисні.
У кисні згоряють не тільки тверді речовини, а й гази, наприклад водень. Для добування водню на дно пробірки помістимо декілька гранул цинку та доллємо хлоридну кислоту. Пробірку закриємо корком з газовідвідною трубкою. Згодом поверхня гранул укриється пухирцями газу, вій виділяється через трубку. Зберемо його в пробірку, перевернуту вгору дном, і перевіримо на чистоту.
У такому ж положенні пробірку піднесемо до полум’я нагрівного приладу. Якщо водень чистий, він спокійно загоряється, а якщо ні, то процес супроводжується різким звуком. Після перевірки запалимо водень, що виділяється з газовідвідної трубки. Газ загоряється й горить блакитним полум’ям. Утворюються молекули води.
– Напишіть самостійно рівняння реакції та пригадайте, як перевірити утворення води.
Взаємодія кисню з металами. У кисні згоряють і деякі метали, зокрема магній, залізо.
Дослід 3. Горіння магнію в кисні.
Нагріємо в полум’ї магнієву дротину, умонтовану в тримач, і опустимо в колбу з киснем. Магній згоряє яскраво-сліпучим полум’ям, розсипаючи іскри (рис. 66). До речі, магній, як хімічно активний метал, згоряє і на повітрі.
Подібно до неметалів магній, згоряючи в кисні або в атмосфері повітря, утворює магній оксид:
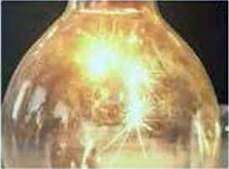
Рис. 66. Горіння магнію в кисні
Отже, у кисні горять деякі метали з утворенням відповідних оксидів.
Горіння – це процес окиснення.
Горіння – це реакції окиснення речовин, що відбуваються з виліченням тепла й світла.
– Пригадайте, як кисень реагує із залізом. Відтворіть рівняння реакції.
Речовини фосфор, сірка, вуглець, магній, залізо вступають у реакції з киснем у вільному стані з утворенням складних речовин, до складу яких входить елемент Оксиген.
– Проаналізуйте склад речовин, що утворилися після реакцій горіння неметалів і металів.
Повільне окиснення. Не всі речовини реагують з киснем однаково. Деякі реакції їх взаємодії з киснем відбуваються без виділення світла, а в умовах, коли речовина реагує повільно, теплота виділяється поступово, без загоряння. Розглянемо приклад.
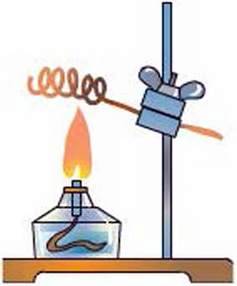
Рис. 67. Окиснення мідної дротини
Дослід 4. Окиснення міді. Мідну дротину, закручену в спіраль, нагріємо в полум’ї. (Для видимих змін, що відбуваються з дротиною, достатньо кисню повітря). На поверхні дротини утворюється чорний наліт – купрум(ІІ) оксид. Горіння не спостерігається, але утворення речовини чорного кольору свідчить, що реакція відбулася (рис. 67). Такий процес називають повільним окисленням. Речовина, що реагує з киснем, окислюється.
Поняття “окиснення” є більш загальним від поняття “горіння”. Одночасно з окисненням проходить інший процес – відновлення, який ви вивчатимете трохи пізніше.
Рівняння реакції окиснення міді:
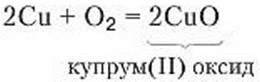
Ця реакція спостерігається в природних умовах. Мідна чи алюмінієва бляха з часом окиснюється з утворенням захисної окисної плівки, срібні вироби вкриваються чорним нальотом. Теплоту повільного окиснення використовують у теплицях.
Процеси окиснення відбуваються в організмах людини, рослин і тварин. Їх називають диханням. Дихання – це сукупність реакцій окиснення органічних речовин, унаслідок чого вивільняється енергія, що забезпечує роботу всіх органів. Інакше кажучи, дихання – це процес газообміну між організмом і зовнішнім середовищем. Вдихаючи повітря, що містить кисень, органічні речовини окиснюються до вуглекислого газу та водяної пари й виводяться назовні під час видихання. Нестача кисню в повітрі або забруднене повітря спричиняють порушення регуляції дихання.
Отже, кисень відіграє важливу біологічну роль – здатність підтримувати обмін речовин і життєдіяльність організмів завдяки реакціям окиснення.
Озон. Під час проходження через кисень електричного розряду він перетворюються па озон. Це газ блакитного забарвлення, з різким запахом. Озон розчинний у воді й органічних розчинниках, отруйний.
У хвойних лісах, що багаті на смолисті речовини, останні мають здатність окиснюватися з виділенням озону. Під дією грозових розрядів в атмосфері теж відбувається перетворення кисню на озон: 3О2 ⇆ 2О3 (рис. 68).
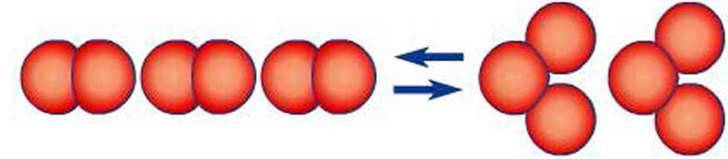
Рис. 68. Схема утворення озону з кисню
У разі сильного охолодження за температури -112,3 °С і тиску 150 атм озон утворює темно-фіолетову рідину, яка твердне за температури -251,5 °С, утворюючи такого ж забарвлення кристали.
Озон активніший за кисень, легко знебарвлює фарби, руйнує органічні сполуки. Окиснювальні властивості озону застосовують для відбілювання тканин, дезінфекції повітря, знезараження водопровідної води.
В атмосфері озон розміщений суцільним шаром на висоті від 10 до 60 км з найбільшою концентрацією на позначках 20-25 км.
Озоновий шар захищає живі організми нашої планети від згубного впливу короткохвильового ультрафіолетового випромінювання Сонця. Наукою доведено, що без озонового захисту життя на Землі не існувало б, бо великі дози ультрафіолетового випромінювання спричинюють загибель живих клітин. Озоновий шар захищає Землю від перегрівання, поглинаючи тепло, що відходить від неї.
Реакції сполучення. Реакції взаємодії простих речовин металів і неметалів з киснем належать до реакцій сполучення.
Реакції сполучення – це реакції, піл час яких з двох або більше вихідних речовин утворюється одна складна речовина.
Оксиди. Під час взаємодії речовин з киснем утворюються нові речовини: фосфор(V) оксид Р2О5, карбон(ІV) оксид СО2, сульфур(ІV) оксид SO2, магній оксид MgO та ін. Такі речовини мають загальну назву оксиди й утворюють окремий клас неорганічних сполук.
Оксиди – це складні речовини, утворені двома елементами, один з яких – Оксиген (рис. 69).
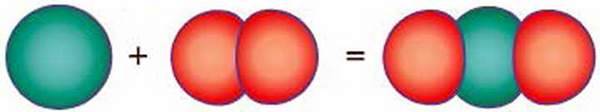
Рис. 69. Схема реакції сполучення вуглецю з киснем з утворенням карбон(ІV) оксиду
Майже всі елементи періодичної системи (виняток становлять лише деякі інертні елементи) мають здатність сполучатися з киснем за нормальних або змінених умов, тобто під час нагрівання, зміни тиску тощо.
ПІДСУМОВУЄМО ВИВЧЕНЕ
– Кисень – речовина, що легко вступає в хімічні реакції з неметалами та металами. Унаслідок цих реакцій утворюються складні речовини – оксиди.
– Реакції кисню з речовинами називають окисненням. Серед реакцій окиснення розрізняють реакції горіння та повільного окиснення.
– Реакції сполучення – реакції, під час яких з двох або більше вихідних речовин утворюється одна складна речовина.
– Оксиди – складні речовини, утворені двома елементами, один з яких – Оксиген.
– Кисень має здатність за певних умов перетворюватися на озон О3 – газ блакитного забарвлення, з різким запахом. Озон – більш активний окисник, ніж кисень.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Обчисліть відносні молекулярні маси кисню й озону О3.
2. Перелічіть фізичні властивості кисню.
3. Сформулюйте визначення реакцій: а) горіння; б) повільного окиснення.
4. Складіть рівняння реакцій горіння вуглецю та магнію.
5. Допишіть продукти реакцій. Поставте коефіцієнти:
A) Si + О2 = ; б) Аl + О2 = ; в) В + O2 = ; г) Zn + O2 = .
6. Напишіть рівняння реакцій між речовинами, що подані формулами:
А) Se і O2; б) S і O2; в) Fe і O2; г) Р і O2; г) Са і O2; д) Аl і O2.
7. Поясніть, які з реакцій завдання 5 належать до горіння, а які – до окиснення.
8. Під час реакції горіння вуглецю масою 2,4 г утворився карбон(IV) оксид масою 8,8 г. Обчисліть масу кисню, що вступив у реакцію.
9. Напишіть рівняння реакцій: а) між кальцієм і киснем;
Б) фосфором і киснем; в) силіцієм і киснем; г) добування кисню з гідроген пероксиду; г) добування кисню з калій перманганату; д) окиснення цинку; е) окиснення міді; є) добування кисню з калій хлорату КСlО3. Класифікуйте реакції за типами. Назвіть утворені продукти реакцій.
ЦІКАВО ЗНАТИ
– Кисень у рідкому стані притягується магнітом.
– Людина за одну хвилину вдихає 5 см3 кисню, а за добу – 7200 см3 або 72 м3.
– У 1982 р. вчені виявили над Антарктидою “озонову дірку”, яка на цей час має діаметр понад 1000 км і переміщається до Австралії. Причиною пошкодження озонового шару є безгосподарна діяльність людини: забруднення повітря газами фреонами. Доведено, що одна молекула фреону знищує 100 тис. молекул озону. Через це застосування фреонів різко скорочено. Однак до подолання цієї проблеми далеко, бо фреони зберігаються в атмосфері 50-100 років.
