Хлороводень. Хлоридна кислота. Хлориди
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ
§ 21. Хлороводень. Хлоридна кислота. Хлориди
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати властивості хлороводню, хлоридної кислоти, хлоридів; способи їх добування; практичне значення; складати рівняння та схеми електронного балансу відповідних хімічних реакцій.
Хлороводень. Атоми в лінійній молекулі хлороводню HCl сполучені ковалентним полярним зв’язком (мал. 27). Кристалічна гратка твердого хлороводню – молекулярна. Хлор у цій
Фізичні властивості. Хлороводень за стандартних умов – безбарвний газ із різким запахом, токсичний, важчий за повітря, леткий, має низькі температури плавлення та кипіння (tпл = -114 °C, tкип = -85 °C), на вологому повітрі димить, утворюючи з парою води дрібні крапельки хлоридної кислоти. Під час вдихання хлороводень подразнює дихальні шляхи і спричиняє ядуху. Нюхати його треба обережно!
Хлороводень добре розчиняється у воді з виділенням великої кількості теплоти: за н. у. в 1 об’ємі води розчиняється до 500 об’ємів хлороводню. Розчин хлороводню у воді називається хлоридною
– Порівняйте розчинність хлороводню та хлору. Поясніть причину відмінності.
Дослід 1. У круглодонну колбу, наповнену хлороводнем, внесемо піпеткою 1-2 краплі води. Отвір одразу закриємо пробкою зі скляною трубкою, кінець якої зануримо у посудину з водою, забарвленою фіолетовим лакмусом. Спостерігаємо швидке наповнення колби водою і зміну фіолетового забарвлення розчину лакмусу на червоне (мал. 28). Отже, у колбі розчин хлоридної кислоти.
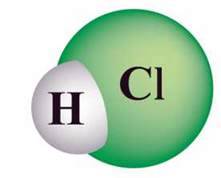
Мал. 27. Модель молекули хлороводню
Добування. У лабораторії хлороводень добувають взаємодією кристалічного натрій хлориду з концентрованою сульфатною кислотою при нагріванні:
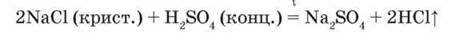
За відсутності води хлороводень виділяється у вигляді газу, і реакція перебігає до кінця.
Дослід 2. (Виконується у витяжній шафі.)
У хімічну колбу з натрій хлоридом наллємо концентровану сульфатну кислоту (мал. 29). Суміш почне пінитися – це виділяється хлороводень. Почервоніння внесеного у склянку зволоженого папірця універсального індикатора вказує на утворення кислоти. Про те, що склянка наповнилася хлороводнем, свідчить поява білого диму з дрібних крапель хлоридної кислоти над її отвором і характерний запах хлороводню.
Якщо сульфатну кислоту взяти в надлишку і суміш несильно нагрівати, то утвориться кисла сіль натрій гідрогенсульфат:
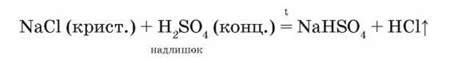
Збирають хлороводень витісненням повітря у суху посудину дном донизу.
У промисловості хлороводень добувають синтезом, тобто прямим сполученням хлору з воднем:
Хімічні властивості. Сухий хлороводень хімічно інертний і не реагує навіть з активними металами. За наявності вологи такі реакції відбуваються, оскільки в реакцію вступає вже не хлороводень, а хлоридна кислота.
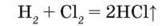

Мал. 28. Розчинність хлороводню у воді
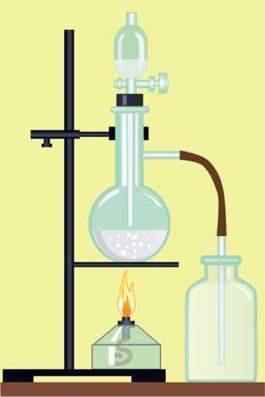
Мал. 29. Добування хлороводню
Хлоридна кислота – не індивідуальна речовина, а розчин хлороводню у воді. Це безбарвна, летка рідина. Масова частка хлороводню в концентрованій хлоридній кислоті становить близько 37 %, на вологому повітрі вона “димить”, бо з неї виділяється газуватий хлороводень.
Хлоридна кислота – сильний електроліт. Ступінь її дисоціації у розбавлених розчинах досягає 90 %. Дисоціює за рівнянням:
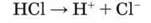
Наявність йонів H+ у хлоридній кислоті доводиться за допомоги індикаторів.
Хлоридна кислота виявляє хімічні властивості, типові для класу кислот, а саме: реагує з металами, що розташовані у витискувальному ряді до водню, з виділенням водню; основними та амфотерними оксидами; основами та амфотерними гідроксидами, солями слабких і летких кислот, а також із такими, що утворюють з хлоридною кислотою нерозчинні солі або слабкі кислоти:
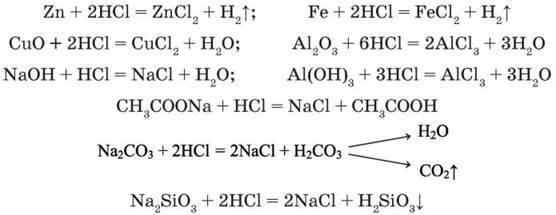
Поясніть, чому кожна з розглянутих реакцій перебігає до кінця. Підтвердіть йонними рівняннями реакцій.
Специфічні властивості хлоридної кислоти зумовлені тим, що Хлор в її молекулі, маючи найменший для нього ступінь окиснення -1, може виявляти в реакціях відновні властивості. Так, концентрована хлоридна кислота реагує з сильними окисниками з утворенням вільного хлору. Наведіть приклад реакцій хлоридної кислоти з окисниками.

Мал. 30. Солі хлоридної кислоти: а – CoCl2; б – CuCl2; в – FeCl3; г – NiCL
Хлориди – це солі хлоридної кислоти. Деякі з них трапляються у природі (див. мал. 23). Забарвлення їм надають катіони (мал. 30). Більшість хлоридів, за винятком хлоридів Аргентуму AgCl, Плюмбуму PbCl2, Меркурію Hg2Cl2, добре розчиняється у воді. Нерозчинність AgCl у воді та кислотах використовують для виявлення аніонів Cl-, хлоридної кислоти і хлоридів: унаслідок взаємодії з аргентум нітратом утворюється білий сирнистий осад аргентум хлориду, нерозчинний у сильних кислотах:
AgNO3 + HCl = AgCl + HNO3
Коротко про головне
Хлороводень – безбарвний газ з різким неприємним запахом, отруйний, важчий за повітря, добре розчиняється у воді з утворенням хлоридної кислоти, хімічно інертний. У лабораторії добувають взаємодією кристалічного натрій хлориду з концентрованою сульфатною кислотою, в промисловості – прямим синтезом із водню та хлору.
Хлоридна кислота – розчин хлороводню у воді. Сильний електроліт, виявляє типові хімічні властивості сильних кислот. Застосовується для добування хлору і хлоридів, у виробництві розчинників, барвників, пластмас, для травлення металів, у шкіряній і харчовій промисловості, медицині.
Хлориди – солі хлоридної кислоти, майже всі добре розчинні у воді, виявляють типові хімічні властивості класу солей. Мають широке використання. Добувають за допомоги хлоридної кислоти та хлору.
Якісною реакцію на хлоридну кислоту та розчини її солей є дія розчину аргентум нітрату. При цьому випадає білий сирнистий осад, нерозчинний у сильних кислотах.
