Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
1. Основні хімічні поняття. Речовина
1.8. Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях
Італійський учений А. Авогадро звернув увагу на те, що всі гази однаково стискуються (закон Бойля – Маріотта1), мають однаковий термічний коефіцієнт розширення (закон Гей-Люссака2) та деякі інші спільні властивості. На основі цих законів і власних спостережень А. Авогадро 1811 р. висловив припущення, яке пізніше
Наслідок цього закону: в однакових об’ємах газів, узятих за умов однакової температури і тиску, містяться однакові кількості речовин цих газів.
Один моль будь-якого газу за нормальних умов (н. y.)3 займає об’єм 22,4 л (точніше – 22,41383 л). Цей об’єм називають молярним об’ємом газу. Молярний об’єм газу VM – це об’єм 1 моль даного газу. Молярний об’єм газу визначають за відношенням об’єму газу К(л) до
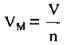
Оскільки густину речовини ρ обчислюють за формулою:
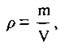
Де m – маса речовини (г), V – об’єм речовини (л), для 1 моль газу можна записати:
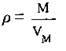
Із цих формул можна розрахувати:
А) молярну масу газу, якщо відома його густина: М = ρ · VM;
Б) густину газу за нормальних умов;
В) молярний об’єм газу: 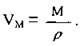
Відносна густина газу (D) – це фізична величина, що визначається відношенням маси певного об’єму газу до маси такого самого об’єму другого газу (температура і тиск мають бути однаковими).
Відносна густина (як і всі відносні величини) не має розмірності. Розрахувати відносну густину одного газу за другим можна, поділивши густину одного газу на густину другого газу. Наприклад:
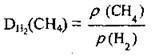
Співвідношення густин двох газів за однакових умов дорівнює співвідношенню їхніх відносних молекулярних мас:
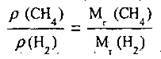
Отже, значення відносної густини можна одержати і за іншими формулами:
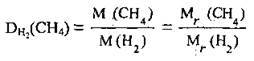
Відносну густину газів часто розраховують за повітрям, наприклад:
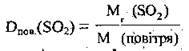
Повітря – це газова суміш, основними компонентами якої є азот і кисень4. Розраховано значення середньої молекулярної маси повітря. Приблизно воно становить 29 (28,98). Це значення лежить у проміжку між числами 28 і 32 – відносними молекулярними масами азоту та кисню, які є основними компонентами повітря. Отже,
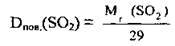
За відомим значенням відносної густини можна розрахувати молярну, масу газу:
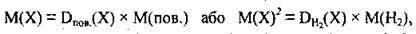
Де Х – невідомий газ.
Масова частка речовини – це відношення маси речовини в суміші до маси суміші; величина безрозмірна. Її виражають у відсотках або часткою від одиниці. Масову частку окремого компонента суміші w(X) встановлюють за формулою:
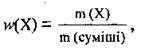
Де m(Х) – маса речовини X, m(суміші) – маса суміші.
Масову частку w (мала латинська літера “w” дубль-ве) елемента Е в речовині розраховують за формулою:
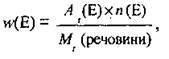
Де Аr(Е) – відносна атомна маса елемента Е, n(Е) – кількість атомів елемента Е у формульній одиниці.
Об’ємна частка речовини – це відношення об’єму газу в суміші до об’єму суміші газів. Як і попередня, величина безрозмірна. Об’ємну частку окремого компонента суміші φ (“фі”) встановлюють за формулою:
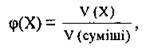
Де V(X) – об’єм речовини X, V(суміші) – об’єм суміші газів.
Для сумішей газоподібних речовин зручно користуватись мольною часткою.
Мольна частка – це відношення кількості речовини компонента газової суміші до сумарної кількості речовин усіх її компонентів; позначається грецькою літерою χ (“хі”):
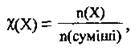
Де n(Х) – кількість речовини X, n(суміші) – кількість речовини суміші.
Зауважимо, що для сумішей газів (за наслідком із закону Авогадро) значення об’ємної та мольної часток збігаються:
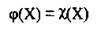
Для суміші газів можна розрахувати її молярну масу, яку називають середньою молярною масою газової суміші. Вона дорівнює масі 1 моль суміші. Оскільки об’ємні частки газів у суміші дорівнюють їхнім мольним часткам, то
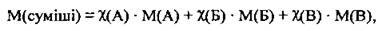
Де М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, χ(А), χ(Б), χ(В) – мольні частки компонентів суміші А, Б і В.
Або можна користуватись таким виразом:
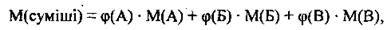
Де М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, φ(А), φ(Б), φ(В) – об’ємні частки компонентів суміші А, Б і В.
Реакції між газоподібними речовинами відбуваються за законом об’ємних співвідношень, який 1808 р. сформулював Ж. Гей-Люссак: за умов незмінного тиску об’єми газів, що реагують і утворюються, співвідносяться між собою як невеликі цілі числа. Коефіцієнти в рівняннях реакцій показують співвідношення об’ємів газів, які реагують і утворюються в результаті реакції.
Наприклад, для реакції синтезу аміаку:
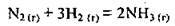
Можна записати співвідношення: 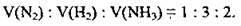
____________________________________________________
1 Роберт Бойль (1627-1691) – англійський хімік, фізик, богослов. Едм Маріотт (1620-1684) – французький фізик, абат.
2 Жозеф Луї Гей-Люссак (1778-1850) – французький хімік і фізик.
3 Під “нормальними (стандартними) умовами” (Standard temperature and pressure, STP) у хімії розуміють фізичні умови зіставлення властивостей речовин: температура – 273,15 К (0 °С), тиск – 101325 Па (760 мм рт. ст., 1 атм). Крім цього, використовують поняття стандартної температури і тиску середовища (Standard Ambient Temperature and Pressure, SATP), які становлять відповідно 298,15 K (25 °С) і 105 Па (або 1 Бар, 750,06 мм рт. ст.). За цих умов константа дисоціації дистильованої води становить 1,0 · 10-14 (характеристики установлені IUPAC 1982 p.).
4 Густина повітря при 0 °С дорівнює 1,3 кг/м3, а при 20 °С – 1,2 кг/м3, тобто кожен кубометр повітря має масу 1,3 кг.
5 Зрозуміло, що “молярна маса повітря” і “відносна молекулярна маса повітря” – величини умовні.
