Амоніак
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ
§ 32. Амоніак
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати будову молекули амоніаку, його фізичні та хімічні властивості, способи добування і застосування; складати рівняння та схеми електронного балансу відповідних хімічних реакцій;
Дотримуватися правил безпечного поводження з амоніаком.
Амоніак – одна з найважливіших сполук Нітрогену, яка має велике практичне значення. Життя на Землі пов’язано зі здатністю деяких бактерій
Хімічна формула амоніаку NH3,електронна 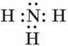 Структурна –
Структурна –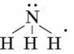
Mr(NH3) = 17; M(NH3) = 17 г/моль.
Будова молекули. Хімічні зв’язки між атомами Нітрогену і Гідрогену в молекулі амоніаку – ковалентні полярні. Молекула має форму піраміди (мал. 49, а, б) і тому полярна. Речовина молекулярної будови.
– Пригадайте і запишіть електронні формули атомів Нітрогену і Гідрогену.
В атома Нітрогену є 3 неспарені р-електрони, які беруть участь в утворенні
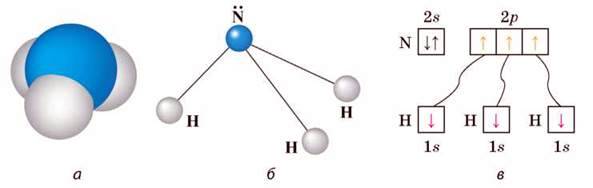
Мал. 49. Амоніак: а – модель; б – просторова будова молекули; в – утворення зв’язків у молекулі амоніаку
Електронні пари сильно зміщені до атома Нітрогену, оскільки електронегативність Нітрогену (3,07) більша, ніж Гідрогену (2,1). Пара 2s-електронів атома Нітрогену залишається незмінною.
Отже, у молекулі амоніаку зв’язки ковалентні полярні, молекула – сильнополярна. Через взаємне відштовхування електронів трьох хімічних зв’язків і неподіленої електронної пари молекула амоніаку має форму піраміди (мал. 49, а). У вершині розміщений атом Нітрогену з неподіленою електронною парою (мал. 49, б).
Наявність трьох ковалентних зв’язків зумовлює валентність Нітрогену в молекулі амоніаку ІІІ, проте за певних умов валентність Нітрогену може збільшитися до чотирьох за рахунок утворення четвертого ковалентного зв’язку за донорно-акцепторним механізмом, як у йоні амонію:
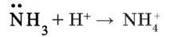
Молекулярна будова, полярність і просторова будова молекули визначають фізичні властивості амоніаку.
Фізичні властивості. За стандартних умов амоніак – газ, безбарвний з характерним різким запахом; tпл= -77,73 °С (амоніак твердне), tкип = -33,34 °С (перетворюється на рідину), густина 0,69 г/см3; дуже добре розчиняється у воді (при 20 °С в одному об’ємі води розчиняється 700 об’ємів NH3), легший за повітря в 1,7 раза.
У рідкому стані молекули амоніаку, як і молекули води, здатні утворювати асоціати за рахунок водневих зв’язків:
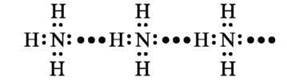
Водневі зв’язки виникають між атомами Гідрогену одних молекул амоніаку, які несуть частковий позитивний заряд, та електронегативними атомами Нітрогену інших молекул амоніаку, що несуть частковий негативний заряд.
З’ясуємо, чому амоніак дуже добре розчиняється у воді? Пояснюється це тим, що, по-перше, молекули амоніаку та води подібні за своєю полярністю і здатністю утворювати водневі зв’язки між молекулами (пригадайте твердження “подібне розчиняється в подібному”). По-друге, амоніак взаємодіє з водою, про що дізнаєтеся, вивчаючи його хімічні властивості.
Фізіологічна дія. Амоніак належить до групи речовин задушливої дії. Його пари дуже подразнюють слизові оболонки очей та органів дихання, а також шкіру. Крім того, зріджений амоніак під час випаровування поглинає теплоту, тому при зіткненні зі шкірою може спричинити обморожування. Отже, якщо відчувається запах амоніаку, то працювати без засобів захисту небезпечно.
Засоби першої допомоги в разі отруєння амоніаком: свіже повітря, промивання очей великою кількістю води, вдихання водяної пари.
Досліди з амоніаком слід проводити у витяжній шафі!
Добування. У лабораторії амоніак одержують дією лугів на солі амонію при нагріванні.
Дослід 1. У ступці змішуємо приблизно рівні об’єми (по чайній ложці) кристалічного амоній хлориду і кальцій гідроксиду (гашеного вапна), висипаємо в пробірку і трохи нагріваємо.
– Запропонуйте спосіб збирання амоніаку в посудину, порівняйте з азотом і хлороводнем.
Амоніак, що виділяється, збираємо в пробірку так, як показано на мал. 50, і закриваємо пробкою. Залишаємо пробірку для подальшого вивчення властивостей амоніаку.
– Після демонстрації досліду дайте відповідь на такі запитання: Чи відчувався запах амоніаку?; Чому пробірку тримають дном догори?; Чи можна збирати амоніак витісненням води? Чому?
Хімічні властивості. Для амоніаку характерні реакції приєднання через наявність вільної пари електронів у Нітрогену й відновні властивості завдяки ступеню окиснення Нітрогену -3.
Реакції приєднання. Амоніак не лише розчиняється у воді, а й взаємодіє з нею.
Дослід 2. Розчинення амоніаку у воді.
Круглодонну колбу заздалегідь наповнюємо амоніаком. На уроці в колбу спочатку вносимо краплю води і сильно струшуємо, закриваємо отвір трубки.
Потім колбу отвором занурюємо у посудину з водою, в яку попередньо додаємо кілька крапель фенолфталеїну, і під водою відкриваємо отвір (мал. 50).
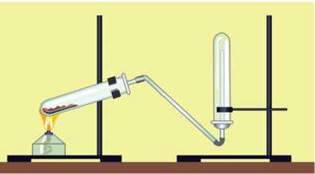
Мал. 50. Прилад для добування амоніаку
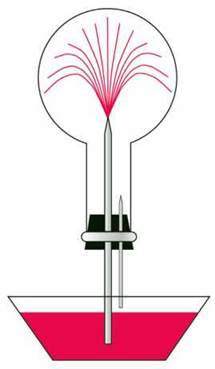
Мал. 51. “Фонтан”
– Опишіть спостереження і поясніть. Чому в колбу з амоніаком спочатку вносять краплю води і сильно струшують? Чому вода “фонтаном” заходить у колбу? До якого процесу (фізичного, хімічного чи фізико-хімічного) можна віднести розчинення амоніаку у воді? Чому розчин набуває малинового забарвлення?
Малинове забарвлення свідчить про утворення в розчині гідроксид-іонів ОН – . Звідки вони в розчині? Причина полягає в тому, що за донорно-акцепторним механізмом електронна пара атома Нітрогену переходить на вакантну орбіталь йона Гідрогену молекули води й утворюються йони амонію:
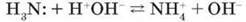
Реакція взаємодії амоніаку з водою є оборотною. У водному розчині амоніаку більше молекул NH3, ніж йонів амонію NH+ і гідроксид-іонів OH-. Тому формулу амоній
Гідроксиду записуємо не NH4OH, а NH3 – Н2О. Отже, молекули NH4OH не існує. Під час взаємодії амоніаку з водою встановлюється рівновага:
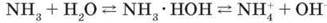
Саме наявність гідроксид-іонів у розчині зумовлює лужне середовище і малинове забарвлення розчину. Водний розчин амоніаку називають нашатирним спиртом.
Взаємодія амоніаку з кислотами.
Дослід 3. Взаємодія амоніаку з гідроген хлоридом.
Змочений концентрованим розчином амоніаку циліндр піднесемо до циліндра, змоченого концентрованою хлоридною кислотою. З’являється білий дим, який поступово осідає на стінках циліндра і перетворюється на красиві безбарвні кристали солі – амоній хлориду: NH3 + HCl = NH4Cl
Зверніть увагу на те, що сполука NH4Cl утворена двома видами хімічного зв’язку: в йоні амонію зв’язки ковалентні полярні, а між йонами амонію і Хлору – зв’язок йонний.
Відновні властивості амоніаку. Ступінь окиснення Нітрогену в молекулі амоніаку -3 зумовлює лише відновні властивості амоніаку.

Мал. 52. Горіння амоніаку в кисні
Амоніак не горить на повітрі, але в середовищі чистого кисню горить жовтим полум’ям (мал. 52):
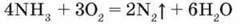
-Складіть схему електронного балансу і доведіть відновні властивості амоніаку.
Процес окиснення амоніаку відбуватиметься інакше, якщо проводити його за наявності каталізатора. Він дає змогу направити процес більш економічним шляхом: за рахунок утворення не азоту, а нітроген(ІІ) оксиду:
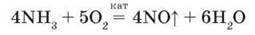
При нагріванні амоніаку з оксидами важких металічних елементів і галогенами він відновлюється до вільного азоту:
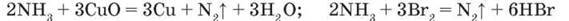
– Для всіх рівнянь реакцій складіть схеми електронного балансу і доведіть відновні властивості амоніаку.
Біологічне значення амоніаку полягає в тому, що він є продуктом азотистого обміну в організмі людей і тварин. Утворюється під час метаболізму білків, амінокислот та інших нітрогеновмісних сполук. Амоніак дуже токсичний для організму. Тому більша частина його перетворюється печінкою в менш шкідливу речовину – карбамід (сечовину), яка частково виводиться нирками.
Застосування. Амоніак – важливий продукт хімічної промисловості. Сучасна промисловість використовує десятки мільйонів тонн амоніаку на рік. Основна кількість його переробляється в нітроген(ІІ) оксид NO і далі в нітратну кислоту. Тому підприємства з виробництва амоніаку зазвичай розміщують безпосередньо біля заводів-виробників нітратної кислоти.
Частково амоніак використовують для добування вибухових речовин, сечовини (NH2)2CO як мінерального добрива, обробки силосу. Він є сировиною для синтезу пластмас та штучних волокон, наприклад капрону. Входить до складу мийних засобів для прання білизни, чищення скла, килимів і ювелірних виробів, вибавляння плям. Рідкий амоніак використовують як холодоагент в аміачних холодильних установках. Нашатирний спирт застосовується в медицині.
Коротко про головне
Амоніак NH3 має певні особливості, пов’язані з будовою його молекули:
1) висока полярність зв’язку N-H, наявність вільної пари електронів у молекулі, що зумовлює високу розчинність амоніаку у воді;
2) амоніак може бути донором електронів, утворюючи ковалентний зв’язок за донорно-акцепторним механізмом з йоном Гідрогену (акцептор), в результаті утворюється йон амонію NH+. Цим пояснюється взаємодія амоніаку з водою і кислотами;
3) у водному розчині амоніак існує переважно у вигляді молекул NH3, тому формулу амоній гідроксиду записують не як NH+4а як NH3 – Н2О. Молекули NH4ОН не існує. Водний розчин амоніаку має лужне середовище, називається нашатирним спиртом;
4) ступінь окиснення Нітрогену в молекулі амоніаку -3, тому в реакціях амоніак – сильний відновник. Фізичні й хімічні властивості амоніаку зумовлюють його практичне використання.
