Атомна одиниця маси. Відносна атомна маса хімічних елементів
Тема 1
ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ
Урок 8
Тема. Атомна одиниця маси. Відносна атомна маса хімічних елементів
Цілі уроку: розширити знання учнів про періодичну систему елементів; закріпити знання учнів про хімічний елемент, хімічну символіку; ознайомити учнів з поняттям абсолютної та відносної атомної маси, одиницею вимірювання відносної атомної маси – атомною одиницею маси (а. о. м.); навчити визначати відносну атомну масу за періодичною системою хімічних елементів.
Тип уроку: коригування і засвоєння нових знань.
Форми
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, картки із завданнями за періодичною системою.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання
Заслуховуються повідомлення учнів про історію виникнення назв деяких хімічних елементів.
ІІІ. Актуалізація опорних знань
Робота з періодичною системою в парах
Кожна пара одержує кросворд – завдання за назвами хімічних елементів. Зашифровано слова: атом, молекула.
Потрібно дібрати назви хімічних елементів з ІІ, ІІІ, IV, V періодів так, щоб у вертикальному
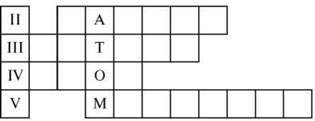
Дібрати назви хімічних елементів за першими літерами слова “молекула” і вказати порядковий номер цих елементів.
Кожна група зашифровує свій результат.
Наприклад:
12 | М | Агній |
76 | О | Сьмій |
57 | Л | Антан |
63 | Е | Йнштейній |
6 | К | Арбон |
92 | У | Ран |
3 | Л | Ітій |
18 | А | Ргон |
Шифр: 12-76-57-63-6-92-3-18.
Групи обмінюються шифрами і за номерами елементів перевіряють, чи правильно дібрані назви. Оцінюється робота групи.
IV. Вивчення нового матеріалу
Атом – найдрібніша частинка речовини. Його розмір можна оцінити в 10-14.
Якщо атом збільшити до розмірів друкарської крапки, то пропорційно збільшена людина матиме зріст близько 7 км.
Тому дійсна (абсолютна) маса атома дуже маленька, наприклад:
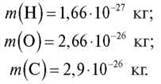
Поняття атомної маси ввів у хімію ще Дж. Дальтон. Оскільки використовувати такі маленькі величини для розрахунків було незручно, запропонували використовувати не реальну, а відносну атомну масу.
За одиницю відліку тривалий час використовували атом Гідрогену як найлегший.
Сьогодні за одиницю відліку приймають величину, що називається атомна одиниця маси (скорочено а. о. м.) і дорівнює 1/12 маси атома Карбону 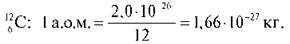
Реальну масу кожного атома розділили на цю величину й одержали відносну атомну масу Аг, що показує, у скільки разів маса атома більша за 1/12 маси атома Карбону.
Одиниця вимірювання [ Ar ] – а. о. м.
Отже, у періодичній системі для кожного хімічного елемента зазначено не реальну, а відносну атомну масу.
Наприклад:

Ми будемо використовувати округлені значення.
V. Закріплення матеріалу
Виконання тренувальних вправ
1) Обчисліть відносну атомну масу Нітрогену, Оксигену, Сульфуру, якщо атомні маси цих атомів відповідно дорівнюють: 2,33 – 10-26 кг; 2,66 – 10-26 кг; 5,32 – 10-26 кг.
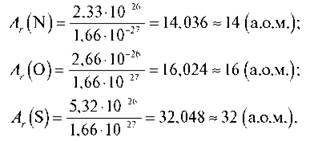
2) З допомогою періодичної системи визначте округлені значення відносної атомної маси таких елементів: Флуор, Натрій, Фосфор, Хлор (35,5), Аргентум, Аурум.
3) Ядро атома складається з протонів і нейтронів. Повернімося до таблиці з масамиp, n, е-. Отже, m(p) = 1,66 – 10-27, тобто відносна маса протона дорівнює 1 а. о. м.
Аналогічною є відносна маса нейтрона – 1 а. о. м. А от електрон дуже маленький, його маса в 1840 разів менша за масу протона і нейтрона. Тоді Ar= p + n. Відносна атомна маса дорівнює кількості протонів і нейтронів.
– Чому дорівнює кількість протонів у атомі? (Порядковому номеру)
– А як знайти кількість нейтронів у атомі? (n = Ar – p)
Наприклад: р = 3; n = 7 – 3 = 4.
Записується 37Li4, а в загальному вигляді – pArEn.
4) Запишіть кількість протонів і нейтронів для Бору, Нітрогену, Флуору, Сульфуру.
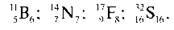
VI. Підбиття підсумків уроку
– Яку нову характеристику атома ми сьогодні вивчили?
– Що показує відносна атомна маса?
– Як обчислити відносну атомну масу?
VII. Домашнє завдання
Прочитати параграф, відповісти на запитання.
Творче завдання. За періодичною системою знайти відносну масу, число протонів і нейтронів для атомів Неону, Магнію, Алюмінію, Калію і записати у формі таблиці.
Назва хімічного елемента | Хімічний символ | Порядковий номер | Відносна атомна маса | Заряд ядра атома | Np | Ne – | Nn |
Mg | |||||||
Алюміній | |||||||
10 | |||||||
39 | |||||||
20 |
