Добування і зберігання кисню
Контрольні запитання
№ 1. Реакції відбуваються при дуже високих температурах, тому їх використовувати для добування кисню в лабораторії не дуже зручно.
№ 2. Відповідь: а) калій перманганат КМnO4; в) вода Н2O;
№ 3. Реакції, внаслідок яких з однієї складної речовини утворюється дві чи більше нових речовин, називають реакціями розкладу.
Приклади: 2КСlO3 = 2КСl + 3O2
2Н2O2 = 2Н2O + 2O2
2HgO = 2Hg + O2
№ 4. Великі кількості кисню добувають із рідкого повітря. Спочатку повітря охолоджують до -200 °С, а потім поступово нагрівають. При -196 °С азот випаровується,
№ 5. Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять до складу утворених продуктів реакції. Тому їхні формули не пишуть ні в лівій, ні в правій частині рівнянь хімічних реакцій.
№ 6. Реакції добування кисню є реакціями розкладу, у яких з однієї речовини утворюється декілька. Часто вони відбуваються за участю каталізаторів – речовин,
№ 7. Наявність кисню можна довести за допомогою тліючої скіпки. За наявності кисню вона яскраво спалахує, тому що кисень підтримує горіння.
№ 8. Існує два способи збирання газоподібних речовин: витісненням води та витісненням повітря. Витісненням води збирають лише ті гази, які в ній погано розчиняються. Якщо газоподібна речовина добре розчиняється у воді, то не витісняє її з посудини.
Кисень погано розчинний у воді. Тому для його збирання можна скористатися цим способом.
Другим способом збирання газів – витісненням повітря – можна збирати всі газоподібні речовини. Слід визначитись з тим, як розташовувати посудину-приймач – догори дном чи навпаки.
№ 9. Добутий рідкий кисень зберігають у спеціальних ємностях – посудинах Дьюара, які за будовою нагадують звичайний термос. Посудина Дьюара має дві стінки, із простору між якими відкачене повітря. У спеціальних сталевих балонах під високим тиском, щоб він займав менше місця.
№ 10. Балони зафарбовують у синій колір, щоб не сплутати балон із киснем із балоном, наповненим іншим газом. Вентилі балонів не можна змащувати машинними мастилами, оскільки навіть залишки мастила в потоці чистого кисню спричиняють сильний вибух.
Завдання для засвоєння матеріалу
№ 1. У лабораторії кисень добувають з його сполук, які при нагріванні легко видаляють кисень. Найчастіше для цього використовують калій перманганат КМnO4, калій хлорат КСlO3(бертолетову сіль), калій нітрат KNO3) (індійську селітру), гідроген пероксид Н2O2.
2КСlO3 = 2КСl + 3O2
2КМNO4 = К2МnO4 + МnO2 + O2
2Н2O2 =2Н2O + O2
№ 2. Формули сполук:
H2O, K2O, MgO, Al2O3, CO2, P2O5, SO3.
№ 3.
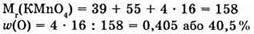
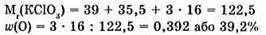
Відповідь: вміст Оксигену більший (за масовою часткою) у калій перманганаті.
№ 4. Маса склянки збільшиться.
№ 5.
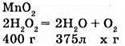
Так як густина води 1 г/см3, то маса води, яка виділилася, 375 г. Згідно з законом збереження маси речовин у хімічних реакціях, маса речовин, що вступають у реакцію, дорівнює масі утворених речовин, маємо: 400 – 375 = 25 г.
Відповідь: маса води 25 г.
№ 6.
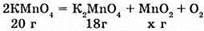
Згідно з законом збереження маси речовин у хімічних реакціях, маса речовин, що вступають у реакцію, дорівнюють масі утворених речовин, маємо: 20 – 18 = 2 г.
Об’єм, який займає кисень:
1 л кисню – 1,43 г
X л кисню – 2 г
X = 1 • 2 : 1,43 = 1,4 л
Відповідь: маса кисню 2 г; об’єм кисню 1,4 л.
№ 7. Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять до складу утворених продуктів реакції. Тому їхні формули не пишуть ні в лівій, ні в правій частині рівнянь хімічних реакцій.
ПРАКТИЧНА РОБОТА № 4.
Тема. Добування кисню з гідроген пероксиду, збирання, доведення його наявності.
Мета роботи: освоїти одержання кисню лабораторним способом та навчитись виявляти його наявність.
Реактиви: гідроген пероксид, манган(ІV) оксид, скіпка.
Обладнання: лабораторний штатив, пробірки, спиртівка, колба, кутова скляна трубка, гумові пробки (з отвором і без), піпетка.
Правила безпеки:
– при проведенні дослідів використовуйте невеликі кількості реактивів;
– остерігайтеся потрапляння реактивів на одяг, шкіру, в очі;
– пам’ятайте, що холодні та гарячі предмети на зовнішній вигляд однакові, нагрівання здійснюйте тільки з використанням спеціальних тримачів;
– обережно поводьтеся при закріпленні пробірок у штативі.
Хід роботи.
Запишемо рівняння реакції отримання кисню: 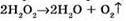
Запишемо рівняння реакції горіння вуглецю: 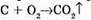
Висновки.
1. Ознайомилися з лабораторним способом добування кисню.
2. Добули і зібрали кисень, методом витіснення повітря.
3. Довели наявність кисню за допомогою скіпки, що жевріє.
4. Сформували поняття про каталізатор та реакцію розкладу на прикладі реакції добування кисню.
5. При горінні утворився вуглекислий газ, який можна визначити за допомогою вапняної води.
Послідовність дій | Спостереження | Висновок |
Завдання 1. Добування та збирання кисню | ||
1. Зібрали прилад для добування кисню. 2. Перевіріли його на герметичність. 3. Добавили 5 мл водного розчину гідроген пероксиду. 4. У пробірку помістили трохи манган (IV) оксиду. 5. Пробірку закрили пробкою з газовідвідною трубкою. Кінець трубки опустили у склянку. 6. Прогріли всю пробірку, потім нагріли розчин. 7. Зібрали кисень витісненням повітря у пробірку, розташовану отвором вгору. 8. Через 2-3 хв опустили у склянку скіпку, що жевріє, та відразу ж виймали її. 9. Долили у пробірку трохи вапняної води. | 4. Манган (IV) оксид прискорює реакцію розкладу гідроген пероксиду, внаслідок її перебігу не витрачається і не входить до складу її продуктів. 7. Тому що густина кисню більша за густину повітря. 9. Скіпка у склянці яскраво спалахнула. Це доводить, що у пробірці є кисень. 10. Вапняна вода набула білого кольору. Це доказує, що при горінні утворився вуглекислий газ. | 1. Кисень добувають термічним розкладенням гідроген пероксиду. 2. Збирають кисень витісненням повітря у пробірку, розташовану отвором вгору. 3. Кисень підтримує горіння. 4. При горінні утворюється вуглекислий газ, який можна визначити за допомогою побіління вапняної води. |
1. Здійснимо фільтрування суміші речовин, що залишилися у приладі для добування кисню після закінчення реакції. 2. Залишки каталізатора осіли на фільтрі, і | 1. Манган (IV) оксид прискорює реакцію розкладу гідроген пероксиду, внаслідок її перебігу не витрачається і не входить до складу її продуктів. | 1. Кисень добувають каталітичним розкладанням гідроген пероксиду. 2. Речовини-каталізатори можуть пришвидшувати Розкладення гідроген пероксиду, але самі не витрачаються. |
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Дія гідроген пероксиду на сирі та відварені овочі, м’ясо.
Що робили | Спостереження |
Завдання 1. Одночасно нанесли по кілька крапель гідроген пероксиду на свіжі зрізи сирих і варених овочів: картоплі, моркви, буряка. | На поверхні сирих овочів виділяються бульбашки газу, тому що під дією каталізаторів відбувається розклад гідроген пероксиду: 2Н2O2 = 2H2O + 2O2 |
Завдання 2. Одночасно нанесли по кілька крапель гідроген пероксиду на шматочок сирого (що не було заморожене) та шматочок відвареного м’яса. | На шматочці сирого м’яса виділяються бульбашки газу, тому що під дією каталізаторів-ферментів відбувається розклад гідроген пероксиду: 2Н2О2 = 2H2O + 2O: На шматоці відвареного м’яса не виділяються бульбашки газу, тому що під дією температури при варенні м’яса відбулося порушення структури каталізаторів-ферментів і розклад гідроген пероксиду не відбувся. |
