Досягнення моделі Бора – Модель атома Бора
БУДОВА АТОМА
4. Модель атома Бора
Поштовхом для подальшого розвитку моделі атома Нільсоном Бором став відкритий у 1885 році Дж. Бальмером факт, що довжини хвиль усіх ліній видимого спектра газоподібного водню можна обчислити простою математичною формулою:
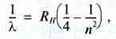
λ – довжина хвилі лінії спектра;
RН – стала Рідберга;
N – порядкове число (n > 2).
N | λ/нм | Лінія | Колір |
3 | 656 | Нα | Червоний |
4 | 486 | Нβ | Синій |
5 | 434 | Нγ | Фіолетовий |
6 | 410 | Нδ | Фіолетовий |
Для
– енергію неможливо поділити на які завгодно малі порції. Так само як і в матерії, існує найменша порція енергії – квант енергії;
– енергія електромагнітного випромінювання залежить від відповідної довжини хвилі цього випромінювання.
Е = h ∙ f,
Е – енергія фотона;
H – стала Планка;
F – частота фотона.
У своїй моделі атома Бор використав уявлення про ядерну модель і електрони, що обертаються навколо атомного ядра.
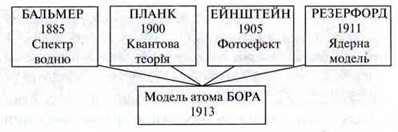
Незважаючи на суперечності, характерні для ядерної моделі, Бор на основі квантової теорії сформулював два робочих припущення, так звані постулати.
Постулат – це припущення, що приводить до прийнятного результату, хоча теоретично його неможливо обгрунтувати. На противагу постулату гіпотеза повинна відповідати прийнятій теорії.
1-й постулат Бора (про орбіти електрона):
Електрони обертаються навколо атомного ядра по певних (стаціонарних) орбітах, не випромінюючи і не поглинаючи енергію. При цьому енергія електронів має лише строго визначені значення, які відповідають даній орбіті.
2-й постулат Бора (про зміну електронної орбіти):
Перехід електрона з віддаленішої від ядра орбіти на ближчу до нього відбувається стрибкоподібно і супроводжується випромінюванням (фотона) з частотою f.
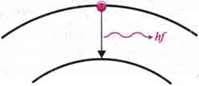
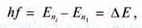
Eni – енергія електрона на віддаленішій від ядра орбіті;
Еn1 – енергія електрона на ближчій до ядра орбіті.
Число n1 … ni завжди є цілим числом і описує можливі орбіти, на яких може обертатися електрон. Орбіта з n1 = 1 має найменшу енергію, вона розташована найближче до ядра, n1=2 описує орбіту з більшою енергією, вона розташована далі від ядра.
Запам’ятайте: число п дає інформацію про можливі кванти енергії. Тому його називають головним квантовим числом.
Досягнення моделі Бора
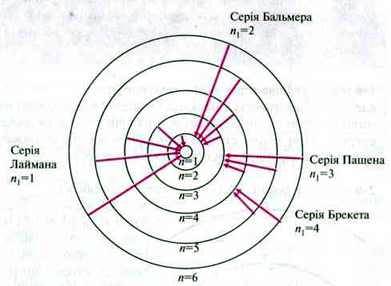
– Модель Бора дозволила пояснити відомі серії ліній спектра водню.
– Інші серії ліній спектра водню у невидимому діапазоні були передбачені, а згодом експериментально підтверджені.
– Для спектра водню вдалося скласти загальну формулу, яка дійсна для усіх серій спектральних ліній:
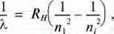
N1 – квантове число для орбіти з найменшою енергією у відповідній серії спектральних ліній;
Ni – квантові числа для орбіт відповідно з вищими енергіями;
Ni > n1.
– Вдалося обчислити радіус атома Гідрогену.
