Етилен та його гомологи
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 16. ВУГЛЕВОДНІ
§ 16.6. Етилен та його гомологи
Властивості. Етилен – перший член гомологічного ряду – безбарвний газ з дуже слабким солодкуватим запахом, трохи легший за повітря, малорозчинний у воді.
За хімічними властивостями етилен різко відрізняється від метану, що зумовлено електронною будовою його молекули. Маючи в молекулі подвійний зв’язок, що складається з σ- і
 -зв’язків,
-зв’язків,
 -зв’язку.
-зв’язку.Здатність до реакцій приєднання характерна для всіх алкенів. Розглянемо найтиповіші з них.
1. Приєднання водню. Ця реакція відбувається за наявності каталізатора – тонкоподрібненого нікелю, платини або паладію – при кімнатній температурі:
Pt
CH2=CH2 + H2 −> СН3-СН3.
Приєднання водню до речовини називається реакцією гідрування, або гідрогенізації.
При гідрогенізації олефіни перетворюються на насичені вуглеводні.
2. Приєднання галогенів. Реакція відбувається за
СН2=СН2 + Сl2 -> СlСН2-СНСl.
Дихлоретан
Дихлоретан – рідина, добре розчиняє органічні речовини.
СН2=СН2 + Вr2 −> ВrСН2-СН2Вr.
Диброметан
Реакція приєднання брому є якісною реакцією на ненасичені вуглеводні. Про наявність останніх свідчить знебарвлення червоно-бурої бромної води.
3. Приєднання галогеноводнів:
СН2=СН2 + Н – Сl −>СН3-СН2Сl.
Легко дійти висновку, що галогенопохідні вуглеводнів, наприклад хлористий етил СН3-СН2Сl, можна добути двома способами: або приєднанням до етилену хлороводню, або заміщенням водню в етані на хлор.
Приєднання галогеноводнів до гомологів етилену відбувається за правилом В. В. Марковникова: атом гідрогену приєднується до найбільш гідрогенізованого атома карбону, а атом галогену – до найменш гідрогенізованого. Наприклад:
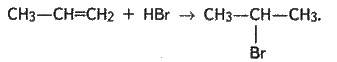
4. Приєднання води (реакція гідратації). Реакція відбувається за наявності каталізатора – сірчаної кислоти:
H2SO4
CH2=CH2 + Н2O -> CH3-СН2ОН.
Це сумарне рівняння реакції. Фактично реакція проходить у дві стадії. Спочатку відбувається приєднання сірчаної кислоти до етилену в місці розриву подвійного зв’язку з утворенням етилсірчаної кислоти:
СН2=СН2 + H-O-SO2-OH -> CH3-CH2-O-SO2-OH.
Далі етилсірчана кислота, взаємодіючи з водою, утворює спирт і кислоту:
СН3-СН2-О-SO2-ОН + Н-ОН −> СН3-СН2ОН + HO-SO2-ОН.
Нині реакцію приєднання води до етилену за наявності твердих каталізаторів застосовують для промислового добування етилового спирту з ненасичених вуглеводнів, що містяться в газах крекінгу нафти (попутних газах), а також у коксових газах.
Важливою хімічною властивістю етилену та його гомологів є здатність легко окиснюватися вже за звичайної температури. При цьому окисненню підлягають обидва атоми карбону, сполучені подвійним зв’язком. Якщо етилен пропускати крізь водний розчин перманганату калію КМnО4, то характерне фіолетове забарвлення останнього зникає, відбувається окиснення етилену перманганатом калію:
ЗСН2=СН2 + 2КМnO4 + 4Н2O -> ЗНОН2С-СН2ОН + 2МnO2 + 2КOН.
Етиленгліколь
Цю реакцію використовують для встановлення ненасиченості органічної речовини – наявності в ній подвійних або потрійних зв’язків.
Етилен горить світним полум’ям з утворенням оксиду карбону(ІV) і води:
С2Н4 + 3O2 −> 2СO2 + 2Н2О.
Для етилену, як і для всіх ненасичених вуглеводнів, характерні реакції полімеризації (див. § 16.7).
Добування. У лабораторних умовах етилен добувають при нагріванні етилового спирту з водовідбираючими речови нами (концентрованою сірчаною кислотою, оксидом фосфору (V) тощо):
H2SO4, нагрівання
С2Н5ОН ” СН2=СН2 + Н2O.
Це – процес, зворотний добуванню спирту з етилену (див. вище). Його можна уявити так. Спочатку спирт взаємодіє із сірчаною кислотою, утворюючи етилсірчану кислоту і воду:
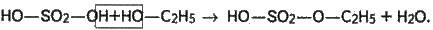
Далі етилсірчана кислота при температурі 180-200 °С розкладається на сірчану кислоту й етилен:
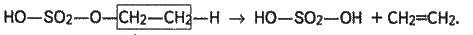
Олефіни добувають також при нагріванні галогенопохідних з концентрованим спиртовим розчином лугу:
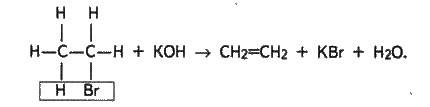
У промислових умовах етилен і його гомологи виділяють з газів крекінгу нафти. Дуже важливий спосіб їх добування – дегідрування відповідних насичених вуглеводнів над нікелевим каталізатором:
Ni
СН3-СН3 −> СН2=СН2 + Н2;
Ni
СН3-СН2-СН3 −> СН2=СН-СН3 + Н2.
Застосування. Етилен застосовують для добування етилового спирту, поліетилену. Він прискорює дозрівання плодів (помідорів, цитрусових тощо) при введенні незначних кількостей його у повітря теплиць. Етилен та його гомологи використовують як хімічну сировину для синтезу багатьох органічних речовин.
